
在一定温度下,溶质溶解在两种互不相溶的溶剂中的浓度之比是一个常数K,若c(A)、c(B)![]() 分别表示溶质在A、B两种溶剂中的浓度,则有c(A)/c(B)=K。对于
分别表示溶质在A、B两种溶剂中的浓度,则有c(A)/c(B)=K。对于![]() 而言,
而言,![]() 。现有2.0L碘水,其中含
。现有2.0L碘水,其中含![]() ,若用
,若用![]() 萃取,按两种方法萃取:第一种方法用50mL
萃取,按两种方法萃取:第一种方法用50mL![]() 萃取一次;第二种方法是分两次萃取,每次用25mL
萃取一次;第二种方法是分两次萃取,每次用25mL![]() 。求两种情况下碘水中残余的
。求两种情况下碘水中残余的![]() 的质量,并指出哪种方法效果好。
的质量,并指出哪种方法效果好。
科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| m |
| (m+1000) |
| m |
| (m+1000) |
| 18V |
| 11.2 |
| 18V |
| 11.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省马鞍山市高三第一次教学质量检测理科综合试卷化学部分(解析版) 题型:填空题
(14分)KCIO3在农业上用作除草剂,超细CaCO3广泛用于生产牙膏、无炭复写纸等。某同学在实验室模拟工业生产,利用制乙炔产生的残渣制备上述两种物质,过程如下:
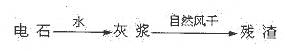
I.残渣中主要成分是Ca(OH)2和 。
II.将I中的部分灰浆配成浊液,通入Cl2在一定的温度下只得到Ca(ClO3)2与CaCl2两种溶质,该反应的化学方程式是 。
Ⅲ、向II所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得49.0克KClO3晶体,则理论上至少需要标准状况下Cl2 升。
Ⅳ、将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:
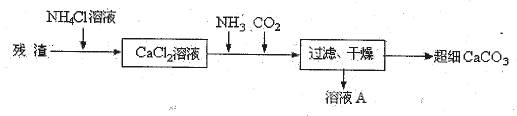
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因 。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是 。
③图示的溶液A可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com