
| A. | 乙醇分子中有1个氢原子与其他氢原子不一样 | |
| B. | 乙醇分子可认为是由乙烷分子中的一个-H被一个-OH取代产生的 | |
| C. | 乙醇分子中的每个碳原子都形成了四个共价键,但显示化合价不是+4价 | |
| D. | 乙醇的相对分子质量为46,相对分子质量为46的有机物就是乙醇 |
分析 A、乙醇的结构简式为CH3CH2OH,其中-OH为官能团;
B、乙醇的结构简式为CH3CH2OH;
C、每个C原子要形成4对共用电子对,但共用电子对偏向于那个原子和元素的非金属性强弱有关;
D、相对分子质量为46的不一定是乙醇.
解答 解:A、乙醇的结构简式为CH3CH2OH,其中-OH为官能团,故-OH中的H原子和其它5个H原子不同,故A正确;
B、乙醇的结构简式为CH3CH2OH,故可以看做是用一个-OH取代了乙烷中的一个H原子,故B正确;
C、每个C原子要形成4对共用电子对,但共用电子对偏向于哪个原子取决于元素的非金属性的相对强弱,故C的化合价不是+4价,是-2价,故C正确;
D、相对分子质量为46的不一定是乙醇,如HCOOH的相对分子质量也为46,故D错误.
故选D.
点评 本题考查了乙醇的分子结构特点和其相对分子质量,难度不大,应注意的是有机物中C元素的化合价因物质不同而不同,要根据物质来具体计算.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成白色沉淀 | |
| B. | 生成红褐色沉淀 | |
| C. | 有气泡产生 | |
| D. | 先生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
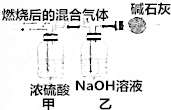
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉遇到KI溶液呈现特殊蓝色 | |
| B. | 淀粉和纤维素属于多糖,其分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 多糖一般不溶于水,没有甜味,没有还原性 | |
| D. | 在稀硫酸作用下,淀粉水解生成葡萄糖和果糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
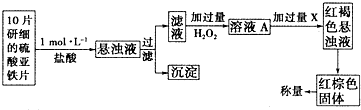
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸沉淀不溶解,说明该溶液一定存在SO42- | |
| D. | 浓硫酸可用于干燥H2、NO2等气体,但不能干燥NH3、SO2等气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com