
”¾ĢāÄæ”ææÉÄę·“Ó¦ 2NO2(g)![]() 2NO(g)+O2(g) ŌŚĢå»ż²»±äĆܱÕČŻĘ÷ÖŠ·“Ó¦£¬“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ
2NO(g)+O2(g) ŌŚĢå»ż²»±äĆܱÕČŻĘ÷ÖŠ·“Ó¦£¬“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ
¢Łµ„Ī»Ź±¼äÄŚÉś³Én molO2µÄĶ¬Ź±Éś³É2n molNO2
¢Śµ„Ī»Ź±¼äÄŚÉś³Én molO2 µÄĶ¬Ź±£¬Éś³É2n mol NO
¢ŪÓĆNO2”¢NO”¢O2 µÄĪļÖŹµÄĮæÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹµÄ±ČĪŖ2 : 2 : 1µÄדĢ¬
¢Ü»ģŗĻĘųĢåµÄŃÕÉ«²»ŌŁøıäµÄדĢ¬ ¢Ż»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁøıäµÄדĢ¬
¢Ž»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁøıäµÄדĢ¬
A. ¢Ł¢Ü¢Ž B. ¢Ś¢Ū¢Ż C. ¢Ł¢Ū¢Ü D. ¢Ł¢Ś¢Ū¢Ü¢Ż¢Ž
”¾“š°ø”æA
”¾½āĪö”æ¢Łµ„Ī»Ź±¼äÄŚÉś³ÉnmolO2µÄĶ¬Ź±Éś³É2nmolNO2Ö¤Ć÷ÕżÄę·“Ó¦ĖŁĀŹŹĒĻąµČµÄ£¬“ļµ½ĮĖĘ½ŗā£¬¹ŹÕżČ·£»
¢Ś·“Ó¦ĖŁĀŹĶ¬·½Ļņ£¬Ī“ĢåĻÖÕż”¢Äę·“Ó¦ĖŁĀŹµÄ¹ŲĻµ£¬¹Ź“ķĪó£»
¢ŪÓĆNO2”¢NO”¢O2µÄĪļÖŹµÄĮæÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹµÄ±ČĪŖ2£ŗ2£ŗ1ČĪŗĪדĢ¬¶¼³ÉĮ¢£¬²»Ņ»¶ØĘ½ŗā£¬¹Ź“ķĪó£»
¢Ü»ģŗĻĘųĢåµÄŃÕÉ«²»ŌŁøı䣬֤Ć÷¶žŃõ»ÆµŖµÄÅØ¶Č²»Ėę×ÅŹ±¼äµÄ±ä»Æ¶ų±ä»Æ£¬Ö¤Ć÷“ļµ½ĮĖĘ½ŗā£¬¹ŹÕżČ·£»
¢Ż»Æѧ·“Ó¦Ē°ŗóÖŹĮæŹĒŹŲŗćµÄ£¬Ģå»żŹĒ²»±ä»ÆµÄ£¬»ģŗĻĘųĢåµÄĆܶČČĪŗĪדĢ¬¶¼²»øı䣬¹Ź“ķĪó£»
¢Ž»Æѧ·“Ó¦Ē°ŗóĪļÖŹµÄĮæ±ä»Æ£¬ÖŹĮæŹŲŗć£¬ĖłŅŌ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ±ä»Æ£¬µ±“ļµ½ĮĖĘ½ŗāדĢ¬£¬²»ŌŁ±ä»Æ£¬¹ŹÕżČ·£»¹ŹŃ”A£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚĆ÷·ÆµÄĖµ·Ø²»ÕżČ·µÄŹĒ
A. »ÆѧŹ½ĪŖKAl(SO4)2”¤12H2O B. ŹōÓŚ»ģŗĻĪļ
C. ŹĒŅ»ÖÖĮņĖįŃĪ D. Ė®ČÜŅŗÄܵ¼µē
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņŗ¬ÓŠĻĀĮŠĄė×ÓµÄČÜŅŗÖŠµĪ¼ÓNaCl²¢ĶØČė×ćĮæSO2ĘųĢåŗó£¬ČÜŅŗÖŠ»¹æÉÄÜ“óĮæ¹²“ęµÄĄė×Ó×éŹĒ£Ø £©
A.NH4+ӢH+ӢNO3-B.H+ӢFe2+ӢSO42-
C.Ag+ӢFe3+ӢSO42-D.Fe3+ӢBa2+ӢHCO3-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠČČ»Æѧ·½³ĢŹ½»ņŠšŹöÕżČ·µÄŹĒ
A. 1 molŅŗĢ¬ėĀŌŚ×ćĮæŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘų£¬·Å³ö642 kJµÄČČĮæ£ŗN2H4(l)+O2(g) ===N2(g)+2H2O(g) ¦¤H£½+642 kJ”¤mol£1
B. 12 gŹÆÄ«×Ŗ»ÆĪŖCOŹ±£¬·Å³ö110.5 kJµÄČČĮæ£ŗ2C(ŹÆÄ«£¬s)+O2(g) ===2CO(g) ¦¤H£½£110.5 kJ”¤mol£1
C. ŅŃÖŖ£ŗH2(g)+ ![]() O2(g) ===H2O(l) ¦¤H£½£286 kJ”¤mol£1£¬Ōņ£ŗ2H2O(l) ===2H2(g)+O2(g)µÄ¦¤H£½+572 kJ”¤mol£1
O2(g) ===H2O(l) ¦¤H£½£286 kJ”¤mol£1£¬Ōņ£ŗ2H2O(l) ===2H2(g)+O2(g)µÄ¦¤H£½+572 kJ”¤mol£1
D. ŅŃÖŖN2(g)+3H2(g) ![]() 2NH3(g) ¦¤H£½£92.4 kJ”¤mol£1£¬ŌņŌŚŅ»¶ØĢõ¼žĻĀĻņĆܱÕČŻĘ÷ÖŠ³äČė0.5 mol N2(g)ŗĶ1.5 mol H2(g)³ä·Ö·“Ó¦·Å³ö46.2 kJµÄČČĮæ
2NH3(g) ¦¤H£½£92.4 kJ”¤mol£1£¬ŌņŌŚŅ»¶ØĢõ¼žĻĀĻņĆܱÕČŻĘ÷ÖŠ³äČė0.5 mol N2(g)ŗĶ1.5 mol H2(g)³ä·Ö·“Ó¦·Å³ö46.2 kJµÄČČĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠĖȤŠ”×éÉč¼Ę”°ĀČĘųÓė½šŹōÄĘ·“Ó¦”±µÄ×°ÖĆ£®ŹµŃé²Ł×÷£ŗĻČøųÄĘŌ¤ČČ£¬µ½ÄĘČŪČŚ³ÉŌ²ĒņŹ±£¬Ķ£Ö¹¼ÓČČ£¬ĶØČėĀČĘų£¬¼“æɼūÄĘ×Å»šČ¼
ÉÕ£¬²¢²śÉś“óĮæ°×ŃĢ£®ŅŌĻĀŠšŹö“ķĪóµÄŹĒ£Ø £©
A.ÄĘ×Å»šČ¼ÉÕ²śÉś²Ō°×É«»šŃęŗĶ°×ŃĢ
B.°×ŃĢŹĒĀČ»ÆÄĘĪ¢¾§·ÖÉ¢ŌŚæÕĘųÖŠŠĪ³É
C.²£¹ÜÖŠ²æČūŅ»ĶŽžÓŠNaOHČÜŅŗµÄĆŽĒņŹĒĪŖĮĖĪüŹÕ¹żĮæµÄĀČĘų£¬ŅŌ·ĄĪŪČ¾»·¾³
D.øł¾Ż¹ÜÓŅ¶ĖĆŽĒņŃÕÉ«µÄ±ä»ÆĒéæö£¬æÉÅŠ¶ĻĀČĘųŹĒ·ń±»¼īŅŗĶźČ«ĪüŹÕ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§ÉśĄūÓĆČēĶ¼ĖłŹ¾×°ÖƶŌµē½āÖŹČÜŅŗµ¼µēŠŌ½ųŠŠŹµŃéĢ½¾æ£®ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £© 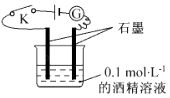
A.±ÕŗĻæŖ¹ŲKŗ󣬵ēĮ÷¼Ę ![]() ÖøÕė²»·¢ÉśĘ«×Ŗ£¬Ö¤Ć÷¾Ę¾«ČÜŅŗŹĒ·Ēµē½āÖŹ
ÖøÕė²»·¢ÉśĘ«×Ŗ£¬Ö¤Ć÷¾Ę¾«ČÜŅŗŹĒ·Ēµē½āÖŹ
B.±ÕŗĻæŖ¹Ų£¬ĶłČÜŅŗÖŠĶØČėĀČĘų£¬Ėę×ÅĘųĢåĶØČė£¬µēĮ÷¼ĘŹ¾ŹżŌö“󣬹ŹĀČĘųŹĒµē½āÖŹ
C.Č”ÓĆ0.1 molL©1µÄÕįĢĒČÜŅŗĢę»»¾Ę¾«ČÜŅŗ£¬µēĮ÷¼ĘµÄŹ¾ŹżĻąĶ¬£¬ĖµĆ÷ÕįĢĒŹĒ·Ēµē½āÖŹ
D.±ÕŗĻæŖ¹Ų£¬ĶłÉÕ±ÖŠ¼ÓNaCl¹ĢĢ壬ĖäČ»¹ĢĢåČܽā£¬ÓÉÓŚ²»·“Ó¦£¬¹ŹµēĮ÷¼ĘÖøÕė²»·¢ÉśĘ«×Ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNOŹĒŅ»ÖÖŠŌÖŹ»īĘƵēóĘųĪŪČ¾Īļ£¬ĖüÄÜÓėŗܶąĪļÖŹ·¢Éś·“Ó¦”£
¢ń”¢ŌŚ2LĆܱÕČŻĘ÷ÄŚ£¬800”ꏱ·“Ó¦£ŗ2NO(g)+O2(g)![]() 2NO2 (g)ĢåĻµÖŠ£¬n(NO)Ėꏱ¼äµÄ±ä»ÆČē±ķ£ŗ
2NO2 (g)ĢåĻµÖŠ£¬n(NO)Ėꏱ¼äµÄ±ä»ÆČē±ķ£ŗ
Ź±¼ä(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
£Ø1£©Š“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½£ŗK=_____”£ŅŃÖŖ£ŗ![]() £¾
£¾![]() £¬ŌņøĆ·“Ó¦ŹĒ___ČČ·“Ó¦”£
£¬ŌņøĆ·“Ó¦ŹĒ___ČČ·“Ó¦”£
£Ø2£©ĻĀĶ¼ÖŠ±ķŹ¾NO2µÄ±ä»ÆµÄĒśĻߏĒ___________”£ÓĆO2±ķŹ¾“Ó0-2 sÄŚøĆ·“Ó¦µÄĘ½¾łĖŁĀŹ
v =___________ӣ

£Ø3£©ĪŖŹ¹øĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹŌö“ó£¬ĒŅĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶ÆµÄŹĒ__________”£
a£®¼°Ź±·ÖĄė³żNO2ĘųĢå b£®ŹŹµ±ÉżøßĪĀ¶Č
c£®Ōö“óO2µÄÅØ¶Č d£®Ń”Ōńøߊ§“߻ƼĮ
¢ņ”¢³¬ŅōĖŁ·É»śŌŚĘ½Į÷²ć·ÉŠŠŹ±£¬Ī²ĘųÖŠµÄNO»įĘĘ»µ³ōŃõ²ć”£æĘѧ¼ŅÕżŌŚŃŠ¾æĄūÓĆ“ß»Æ¼¼Źõ½«Ī²ĘųÖŠµÄNOŗĶCO×Ŗ±ä³ÉCO2ŗĶN2£¬Ęä·“Ó¦ĪŖ£ŗ2NO£«2CO![]() 2CO2£«N2”£ĪŖĮĖ²ā¶ØŌŚÄ³Ö֓߻ƼĮ×÷ÓĆĻĀµÄ·“Ó¦ĖŁĀŹ£¬ŌŚÄ³ĪĀ¶ČĻĀÓĆĘųĢå“«øŠĘ÷²āµĆ²»Ķ¬Ź±¼äµÄNOŗĶCOÅضČČē±ķ£ŗ
2CO2£«N2”£ĪŖĮĖ²ā¶ØŌŚÄ³Ö֓߻ƼĮ×÷ÓĆĻĀµÄ·“Ó¦ĖŁĀŹ£¬ŌŚÄ³ĪĀ¶ČĻĀÓĆĘųĢå“«øŠĘ÷²āµĆ²»Ķ¬Ź±¼äµÄNOŗĶCOÅضČČē±ķ£ŗ
Ź±¼ä(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00”Į10-3 | 4.50”Į10-4 | 2.50”Į10-4 | 1.50”Į10-4 | 1.00”Į10-4 | 1.00”Į10-4 |
c(CO)(mol/L) | 3.60”Į10-3 | 3.05”Į10-3 | 2.85”Į10-3 | 2.75”Į10-3 | 2.70”Į10-3 | 2.70”Į10-3 |
Ēė»Ų“šĻĀĮŠĪŹĢā£Ø¾ł²»æ¼ĀĒĪĀ¶Č±ä»Æ¶Ō“߻ƼĮ“߻Ɗ§ĀŹµÄÓ°Ļģ£©£ŗ
£Ø1£©ÉĻŹöĢõ¼žĻĀ·“Ó¦Äܹ»×Ō·¢½ųŠŠ£¬ŌņøĆ·“Ó¦µÄ”÷H_____0£ØĢīŠ“”°£¾”±”¢”°£¼”±”¢”°£½”±£©”£
£Ø2£©¼ŁÉčŌŚĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬“ļµ½Ę½ŗāŹ±ĻĀĮŠ“ėŹ©ÄÜĢįøßNO×Ŗ»ÆĀŹµÄŹĒ________”£
A£®Ń”ÓĆøüÓŠŠ§µÄ“߻ƼĮ B£®Éżøß·“Ó¦ĢåĻµµÄĪĀ¶Č
C£®½µµĶ·“Ó¦ĢåĻµµÄĪĀ¶Č D£®ĖõŠ”ČŻĘ÷µÄĢå»ż
£Ø3£©Ä³Ķ¬Ń§Éč¼ĘĮĖČż×鏵Ń飬ŹµŃéĢõ¼žŅŃ¾ĢīŌŚĻĀĆꏵŃéÉč¼Ę±ķÖŠ£¬·ÖĪö±ķøńĪŅĆĒæÉŅŌ擳öøĆĶ¬Ń§µÄŹµŃéÄæµÄÖ÷ŅŖŹĒŃŠ¾æ_______________ŗĶ_____________________¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ”£
ŹµŃ鱹ŗÅ | T(”ę) | NO³õŹ¼ÅØ(mol/L) | CO³õŹ¼ÅضČ(mol/L) | “߻ƼĮµÄ±Č±ķĆ껿(m2/g) |
¢ń | 280 | 1.20”Į10-3 | 5.80”Į10-3 | 82 |
¢ņ | 280 | 1.20”Į10£3 | 5.80”Į10£3 | 124 |
¢ó | 350 | 1.20”Į10£3 | 5.80”Į10£3 | 124 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
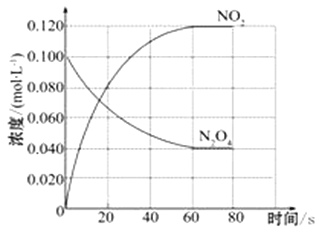
”¾ĢāÄæ”æŌŚČŻ»żĪŖ1.00 LµÄČŻĘ÷ÖŠ£¬ĶØČėŅ»¶ØĮæµÄN2O4£¬·¢Éś·“Ó¦N2O4(g) ![]() 2NO2(g)£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī”£
2NO2(g)£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·“Ó¦µÄ”÷H___________0£ØĢī”°“óÓŚ”±”°Š”ÓŚ”±£©£»100”ꏱ£¬ĢåĻµÖŠø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆČēÉĻĶ¼ĖłŹ¾”£ŌŚ0~60sŹ±¶Ī£¬·“Ó¦ĖŁĀŹv(N2O4)ĪŖ_____________molL-1s-1£¬·“Ó¦µÄĘ½ŗā³£ŹżK1ĪŖ______________”£
£Ø2£©100”ꏱ“ļµ½Ę½ŗāŗó£¬øı䷓ӦĪĀ¶ČĪŖT£¬c(N2O4)ŅŌ0.0020 molL-1s-1µÄĘ½¾łĖŁĀŹ½µµĶ£¬¾10 sÓÖ“ļµ½Ę½ŗā”£
¢Ł T __________100”ę£ØĢī”°“óÓŚ”±”°Š”ÓŚ”±£©£¬ÅŠ¶ĻĄķÓÉŹĒ______________________________________£»
¢Ś ĪĀ¶ČTŹ±·“Ó¦µÄĘ½ŗā³£ŹżK2 ĪŖ ___________________”£
£Ø3£©ĪĀ¶ČTŹ±·“Ó¦“ļĘ½ŗāŗ󣬽«·“ӦȯĘ÷µÄČŻ»ż¼õÉŁŅ»°ė£¬Ę½ŗāĻņ______________£ØĢī”°Õż·“Ó¦”±»ņ”°Äę·“Ó¦”±£©·½ĻņŅĘ¶Æ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼ŹĒ¹¤ŅµÉĻŅŌÓŠ»śĪļA”¢EĪŖ»ł±¾ŌĮĻÖʱøÓŠ»śĪļMµÄŅ»ÖÖŗĻ³ÉĀ·Ļߣ®AÄÜÓėNa2CO3ČÜŅŗ¼°äåĖ®·“Ó¦£¬ĒŅ1molA×ī¶ąæÉÓė2molBr2·“Ó¦£»BµÄ±½»·ÉĻÓŠĖÄÖÖ²»Ķ¬»Æѧ»·¾³µÄĒāŌ×Ó£»E”¢F¾łŹĒ·¼ĻćĢž£»MŹĒŅ»ÖÖ¾ßÓŠĢŲŹāĻćĘųµÄĪļÖŹ”£

ŅŃÖŖ£ŗ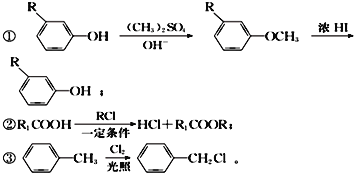
¢Ü·ÓōĒ»łŅ×±»øßĆĢĖį¼ŲĖįŠŌČÜŅŗ”¢ÅØĻõĖįµČŃõ»Æ
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŚFµÄĶ¬ĻµĪļÖŠ£¬Ļą¶Ō·Ö×ÓÖŹĮæ×īŠ”µÄĪļÖŹŹĒ______£ØĢīĆū³Ę£©£»CÖŠŗ¬Ńõ¹ŁÄÜĶŵÄĆū³ĘĪŖ____________£»
£Ø2£©AµÄ½į¹¹¼ņŹ½ĪŖ___________£»E”śFµÄ·“Ó¦ĄąŠĶĪŖ________£»
£Ø3£©D+G”śMµÄ»Æѧ·½³ĢŹ½ĪŖ_____________________________£»
£Ø4£©CµÄĶ¬·ÖŅģ¹¹ĢåÖŠÄÜĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄ¹²ÓŠ______Ö֣ز»ŗ¬Į¢ĢåŅģ¹¹£©£»
¢ŁÓöFeCl3ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦ ¢ŚÄÜ·¢ÉśĖ®½ā·“Ó¦
ĘäÖŠŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾ĪŖ5×é·å£¬ĒŅ·åĆ껿±ČĪŖ2£ŗ2£ŗ2£ŗ1£ŗ1µÄŹĒ_____£ØŠ“½į¹¹¼ņŹ½£©”£
£Ø5£©²ĪÕÕÓŠ»śĪļMµÄÉĻŹöŗĻ³ÉĀ·Ļߣ¬Éč¼ĘŅ»ĢõÓÉ![]() ŗĶ(CH3)3CClĪŖĘšŹ¼ŌĮĻÖʱø
ŗĶ(CH3)3CClĪŖĘšŹ¼ŌĮĻÖʱø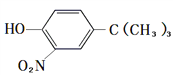 µÄŗĻ³ÉĀ·Ļߣŗ___________________________”£
µÄŗĻ³ÉĀ·Ļߣŗ___________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com