
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.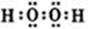 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素,则A为氢元素;B元素的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,因此B的电子排布为1s22s22p2,即B为碳元素;D的基态原子的核外成对电子数是未成对电子数的3倍,则D的电子排布为1s22s22p4,即D为氧元素;B、C、D的原子序数依次递增,因此C为N元素.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,因此M是甲醛.A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,则N是苯.E有“生物金属”之称,E4+和氩原子的核外电子排布相同,则E的原子序数为18+4=22,即E为钛元素.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素,则A为氢元素;B元素的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,因此B的电子排布为1s22s22p2,即B为碳元素;D的基态原子的核外成对电子数是未成对电子数的3倍,则D的电子排布为1s22s22p4,即D为氧元素;B,、C、D的原子序数依次递增,因此C为N元素.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,因此M是甲醛.A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,则N是苯.E有“生物金属”之称,E4+和氩原子的核外电子排布相同,则E的原子序数为18+4=22,即E为钛元素.
(1)A2D2分子是H2O2,含有极性键和非极性键的共价化合物,其电子式为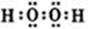 ;Ti的原子序数为22,根据构造原理可知,其电子基态电子排布为1s22s22p63s23p63d24s2,电子最后填充3d电子,则外围电子排布为3d24s2,
;Ti的原子序数为22,根据构造原理可知,其电子基态电子排布为1s22s22p63s23p63d24s2,电子最后填充3d电子,则外围电子排布为3d24s2,
故答案为: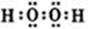 ;3d24s2;
;3d24s2;
(2)B、C、D三种元素分别为C、N、O,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N,
故答案为:C<O<N;
(3)氮元素的最高价氧化物是硝酸,具有强氧化性,在加热的条件下浓硝酸能氧化单质碳,反应的化学方程式是:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)a.甲醛是平面型结构,但由于甲醛分子中共价键的极性不能抵消,所以甲醛是极性分子,而苯是平面正六边形结构,属于非极性分子,故a正确;
b.化合物M为甲醛,碳原子的孤电子对数为0,碳原子的σ键数为3,则碳原子采取sp2杂化.CO2是直线型结构,碳原子是sp杂化,故b错误;
c.苯分子中的碳碳键介于碳碳单键和碳碳双键之间的一种独特的键,所以苯分子中含有12个σ键和1个大π键,故c错误;
d.CO2形成晶体类型是分子晶体,而二氧化硅是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故d正确,
故选:ad;
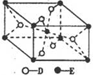
(5)根据晶胞的结构可知,晶胞中含有Ti原子的个数=1+8×$\frac{1}{8}$=2,氧原子个数=2+4×$\frac{1}{2}$=4,所以Q的化学式是TiO2.根据盖斯定律可知,①+②即得到反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g),所以该反应的反应热△H=+140kJ/mol-221kJ/mol=-81kJ/mol,
反应热化学方程式为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol,
故答案为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol;
(6)①合成氨反应是放热反应,所以升高温度平衡向逆反应方向移动,因此平衡常数减小,即K1>K2,
故答案为:>;
②当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,它们的浓度分别是6mol/L、2mol/L、4mol/L,则根据平衡常数表达式可知,此时$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})×c({N}_{2})}$=$\frac{{6}^{2}}{{4}^{3}×2}$=$\frac{9}{32}$<0.5,所以反应向正反应方向移动,即氮气正反应速率大于氮气逆反应速率,
故答案为:>.
点评 本题考查元素周期表的结构和元素周期律的应用、核外电子排布、第一电离能、分子的空间构型、化学键以及晶体的有关判断和计算、反应热的计算、平衡常数的应用和外界条件对平衡状态的影响等,题目比较综合,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用明矾对自来水进行杀菌消毒 | |
| B. | 钠长期放置在空气中,最终将变成碳酸氢钠 | |
| C. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| D. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
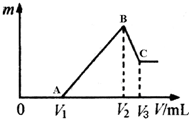 将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
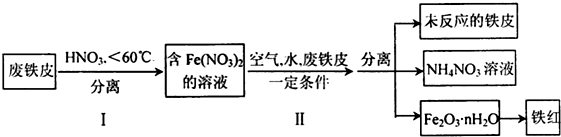
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵和硝酸铵 | B. | 碳酸铵和硝酸铵 | ||
| C. | 碳酸氢铵和氯化铵 | D. | 碳酸铵和氯化铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有$\frac{1}{2}$NA个硫原子被还原 | B. | 有$\frac{1}{3}$NA个氮原子被氧化 | ||
| C. | 有$\frac{3}{4}$NA个二氧化硫分子生成 | D. | 有$\frac{2}{3}$NA个硫酸铵分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4gS02与足量氧气反应生成S03,转移电子数小于0.2NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L0.5mol/L稀硝酸中,当生成2.24LNO时,溶液中氮原子数0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应Na+H2O═Na ++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com