
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| 化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | C2H5OH | FeCl3 |
| W | MgO | Al2O3 | C2H5ONa | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、试管塞越来越紧,是因为反应消耗了大量NH3 |
| B、溶液逐渐变为浅黄色,是因为反应生成了少量的NO2 |
| C、溶液迅速变为蓝色溶液,是因为反应生成了[Cu(H2O)4]2+ |
| D、上述反应原理可用于测定O2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c1 |
| c2 |
| A、1 |
| B、104 |
| C、10-4 |
| D、10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
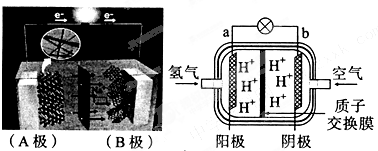
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 |
| B、Cu为正极,Zn为负极,稀H2SO4作电解质溶液 |
| C、Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 |
| D、Fe为正极,Zn为负极,CuCl2溶液作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com