
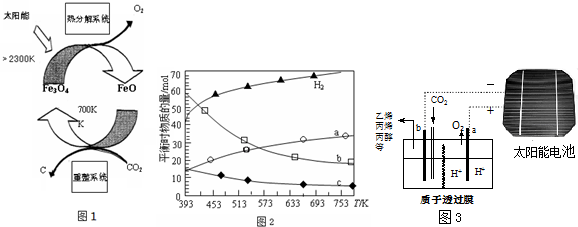
分析 (1)①反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,结合元素化合价以及方程式计算;
②由图1可知重整系统发生反应的化学方程式为:6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4+C;
(2)由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;可知a为CO2的变化曲线,结合计量数关系可知b为水,c为C2H4的变化曲线;
(3)太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,乙烯在阴极生成.
解答 解:(1)①反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2molFe3O4参加反应,生成1mol氧气,转移4mol电子,则每分解lmolFe3O4转移电子的物质的量为2mol,故答案为:2mol;
②由图1可知重整系统发生反应的化学方程式为:6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4+C,故答案为:6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4+C;
(2)①随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线,
故答案为:H2O;
②由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,故答案为:<;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或提高$\frac{n({H}_{2})}{n(C{O}_{2})}$比值,故答案为:增大压强或提高$\frac{n({H}_{2})}{n(C{O}_{2})}$比值;
(3)①太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,可知能量转化形式有光能转化为电能,电能转化为化学能,部分电能转化为热能,
故答案为:光能转化为电能,电能转化为化学能;
②电解时,二氧化碳在b极上生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故答案为:2CO2+12H++12e-=C2H4+4H2O.
点评 本题较为综合,涉及氧化还原、化学平衡移动以及原电池反应等知识,考查了学生分析问题、解决问题的能力,题目难度中等.注意电极正负极的判断以及反应式的书写,注意燃料电池的负极上是燃料发生失电子的氧化反应.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 食盐水任意部分味道相同 | B. | 氯化铁溶液为浅绿色 | ||
| C. | 水不是混合物所以不是溶液 | D. | 在溶液中进行反应时速度较快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;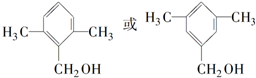 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
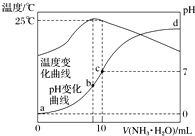 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH${\;}_{4}^{+}$)=c(Cl-)=1.0 mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)计算式为=$\frac{(\frac{n}{2}-0.5)×1{0}^{-7}}{0.5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol•L-1甲酸溶液的pH值约为2 | |
| B. | 甲酸电离出的阳离子全部是H+ | |
| C. | 10mL1 mol•L-1甲酸与10 mL1 mol•L-1NaOH溶液完全反应后,溶液呈碱性 | |
| D. | 1LH+浓度为0.1 mol•L-1的甲酸和足量Zn反应放出的H2在标况下远大于1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
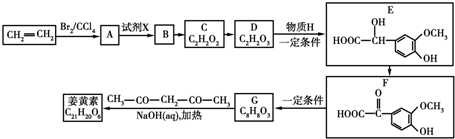


 .
.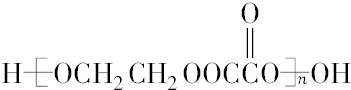 .
.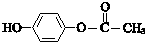 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com