
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 水电解生成氢气和氧气 | D. | 铁器在潮湿的空气中生锈 |
分析 反应能否自发进行,决定于△H-T△S的大小,△H-T△S<0反应能自发进行,△H-T△S>0反应不能自发进行,结合生活常识分析解答,据此分析.
A.微粒向浓度低的方向扩散;
B.冰的熔点为0°C,水常温是液体;
C.水分解不是自发过程,需要电解条件;
D.铁在潮湿的空气中生锈是发生了电化腐蚀.
解答 解:A.扩散现象,需吸收能量,是混乱度变大的自发过程,故A不选;
B.冰融化过程中吸热,△H<0,混乱度增大△S>0,△H-T△S<0是自发过程,故B不选;
C.水电解生成氢气和氧气,该反应为分解反应△H>0,混乱度增大△S>0,不是自发进行的反应,故C选;
D.Fe在潮湿的空气中生锈是缓慢氧化过程,可以自发进行,故D不选.
故选:C.
点评 本题考查了自发进行的变化过程判断,通过身边的化学现象考查对知识的应用,注意理解自发进行的过程和自发进行的反应不同,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将20gNaOH溶解在500mL水中 | |
| B. | 将22.4L HCl气体溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 3mol/L的KCl溶液 | B. | 30mL 1mol/L的NaCl溶液 | ||
| C. | 30mL 3mol/L的FeCl3溶液 | D. | 10mL3mol/L的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | Na+、HCO3-、Cl-、NO3- | ||
| C. | Na+、SO32-、NO3-、K+ | D. | K+、SO42-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
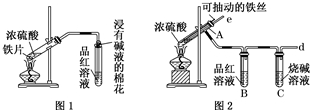 某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
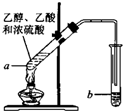 (1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:
(1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
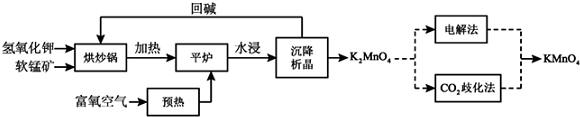
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com