
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是()
X Y
Z W
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
考点: 元素周期律和元素周期表的综合应用.
专题: 元素周期律与元素周期表专题.
分析: 根据Y原子的最外层电子数是次外层电子数的3倍可知,Y为氧元素,根据位置关系推出X为N,Z为S,W为Cl.再根据元素周期性得出正确结论.
解答: 解:A.同一周期,从左到右,原子半径逐渐减小,故X>Y,Z>W,同一主族,从上到下,原子半径逐渐增大,故Z>Y,故原子半径:Z>W>X>Y,故A错误;
B.同一周期,从左到右,最高价氧化物对应水化物的酸性逐渐增强,故最高价氧化物对应水化物的酸性:W>Z,故B错误;
C.同一周期,从左到右,气态氢化物的稳定性逐渐增强,故气态氢化物的稳定性:W>Z,故C错误;
D.根据Y原子的最外层电子数是次外层电子数的3倍可知,Y为氧元素,则W为Cl,氯气能和水反应生成次氯酸,次氯酸具有很强的氧化性,可做漂白剂,具有漂白性,故D正确.
故选D.
点评: 本题考查了元素周期律中位、构、性三者之间的关系,元素的推断是解答的关键,注意原子结构中的关系及非金属性的比较,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
|
| A. | CH4、C2H4 | B. | CH4 、C3H6 | C. | C2H4、C3H4 | D. | C2H2、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L﹣1
盐酸、0.55mol•L﹣1NaOH溶液,实验尚缺少的玻璃用品是.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是
(3)他们记录的实验数据如下:
实验用品 溶液温度 中和热
t1 t2 △H
① 50 mL
0.55 mol•L﹣1
NaOH溶液 50 mL
0.5 mol•L﹣1
HCl溶液 20℃ 23.3℃
﹣56.8kJ/mol
② 50 mL
0.55 mol•L﹣1
NaOH溶液 50 mL
0.5 mol•L﹣1
HCl溶液 20℃ 23.5℃
已知:Q=c m(t2﹣t1),反应后溶液的比热容c为4.18kJ•℃﹣1•kg﹣1,各物质的密度均为1g•cm﹣3.
①计算完成上表.
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:.
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测 定结果(填“有”或“无”)影响.
(5)已知H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol,回答下列问题.
①用含20g NaOH的稀溶液跟足量稀盐酸反应放出kJ的热量.
②用含2mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热△H为.
③如果将反应中的稀盐酸换成稀醋酸,反应放出的热量(填“大于”、“小于”或“等于”)放出的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不能按(“→”表示一步完成)关系相互转化的是( )
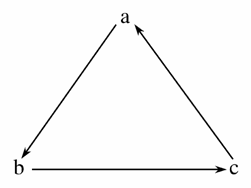
| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | Cl2 | NaClO | NaCl |
| C | Si | SiO2 | H2SiO3 |
| D | HNO3 | NO | NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G、H、M九种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,G、E为气体单质,F的水溶液与石灰水混合可制得D的溶液。它们之间相互转化关系如图所示,其他与题目无关的生成物均已略去。
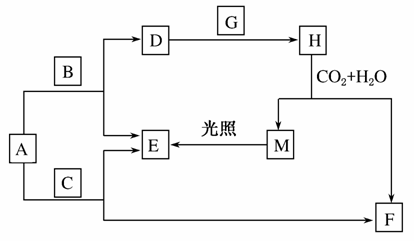
请回答下列问题:
(1)写出化学式:H________,C________。
(2)写出下列反应的化学方程式:
A+C→F+E________________________________________;
F+Ca(OH)2→D_____________________________________。
(3)写出离子反应方程式:D+G→H____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个小烧杯里,加入20g Ba(OH)2•8H2O粉末和10g NH4Cl晶体,将小烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌.回答问题:
(1)实验中玻璃棒的作用是.
(2)该反应的化学方程式为该反应属于(填反应类型).
(3)实验中观察到现象有玻片与烧杯之间结冰黏在一起;.反应混合物呈糊状,呈糊状的原因是.
(4)通过结冰现象,说明该反应为吸热反应,这是由于反应物的总能量(填“大于”、“小于”或“等于”)生成物的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是()
A. CaO2具有氧化性,对面粉可能具有增白作用
B. CaO2中阴阳离子的个数比为1:1
C. CaO2和水反应时,每产生1mol O2转移电子4mol
D. CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质.完成下列有关方程式.
(1)硫代硫酸钠Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式为;
(2)将某黄铜矿(主要成分为CuFeS2)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为.
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生.请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:.
(4)焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:.
查看答案和解析>>
科目:高中化学 来源: 题型:
一些烷烃的燃烧热数值(kJ·mol﹣1)如下:
| 化合物 | 甲烷 | 乙烷 | 丙烷 | 正丁烷 | 异丁烷 | 异戊烷 |
| 燃烧热 (kJ·mol﹣1) | 891.0 | 1560.8 | 2221.5 | 2878.0 | 2869.6 | 3531.3 |
下列推断正确的是
A.正丁烷 异丁烷 △H<0
异丁烷 △H<0
B.乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)===CO2(g)+6H2O(g) △H=﹣1560.8 kJ·mol﹣1
C.正戊烷的燃烧热数值小于3531.3 kJ·mol﹣1
D.相同质量的烷烃,随碳原子数增加,燃烧放出的热量增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com