
分析 ①pH=-lgc〔H+〕,pH相同时,NH3•H2O为弱电解质,在溶液中部分电离,所以需要的浓度最大;Ba(OH)2为二元强碱,所以其浓度最小;
②三种碱溶液的pH相同、体积也相同时,氢氧化钡和氢氧化钠为强电解质,它们含有的氢氧根离子相同,氨水为弱电解质,含有的氢氧根离子物质的量最大;
②pH值相同的NaOH(aq)、Ba(OH)2(aq)、NH3•H2O(aq)各100mL,溶液中氢氧根离子浓度相同;
解答 解:①Ba(OH)2二元强碱,完全电离,NaOH为一元强碱,完全电离,NH3•H2O为一元弱碱部分电离,所以三种碱的pH相同时,NH3•H2O为弱电解质,在溶液中部分电离,所以需要的浓度增大,Ba(OH)2为二元强碱,所以其浓度最小,pH相同,三种溶液浓度由大到小的顺序是,NH3•H2O(aq)>NaOH(aq)>Ba(OH)2(aq),
故答案为:NH3•H2O(aq);
②三种碱溶液的pH相同、体积也相同时,氢氧化钡和氢氧化钠中含有的氢氧根离子相同,氨水为弱电解质,含有的氢氧根离子物质的量最大,与同浓度的HCl中和,消耗HCl体积由多到少的顺序是V1=V2<V3,
故答案为:V1=V2<V3;
③pH值相同的NaOH(aq)、Ba(OH)2(aq)、NH3•H2O(aq)各100mL,溶液中氢氧根离子浓度相同,反应速率相同,
故答案为:D、一样快;
点评 本题考查了pH的计算、弱电解质的电离平衡、酸碱混合后溶液定性判断及溶液pH的计算,题目难度中等,充分考查了学生对溶液PH与浓度关系的知识掌握情况.


科目:高中化学 来源: 题型:解答题
| 实验序号 | 消耗0.1032mol•L-1的氢氧化钠溶液的体积/mL | 待测盐酸溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
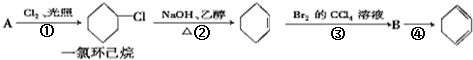
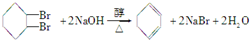 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 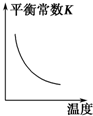 | B. | 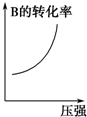 | C. | 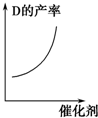 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
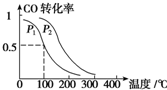 工业上CO 也用于合成甲醇:
工业上CO 也用于合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
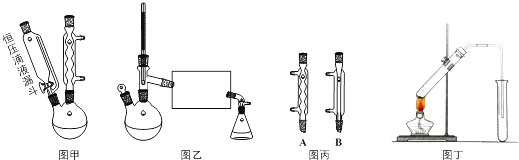
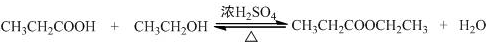 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和H2中至少有一种 | B. | 肯定没有Cl2和HCl | ||
| C. | 肯定有SO2 | D. | 不能确定有无Cl2、HCl、SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com