
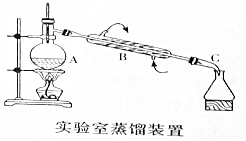
 如图是用自来水制备蒸馏水的实验装置图.
如图是用自来水制备蒸馏水的实验装置图.分析 蒸馏是利用物质的沸点不同分离相互溶解的沸点不同的液体,蒸馏时用到蒸馏烧瓶、酒精灯、冷凝管、牛角管、锥形瓶等仪器,注意温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,为防止溶液爆沸,应加入少量碎瓷片,以此来解答.
解答 解:(1)由仪器的结构可知:A、B、C分别为蒸馏烧瓶、冷凝管、牛角管,
故答案为:蒸馏烧瓶;冷凝管;牛角管;
(2)蒸馏实验时,温度计测量的是蒸汽的温度,所以温度计的水银球未与支管口的下缘相平,
故答案为:温度计的水银球未与支管口的下缘相平;
(3)蒸馏时,为防止溶液爆沸,应加入少量碎瓷片,故答案为:防止液体暴沸;
(4)水的沸点为100℃,则蒸馏时,取100℃的产品即可获得蒸馏水,故答案为:100.
点评 本题考查混合物分离提纯,为高频考点,把握实验装置的作用、实验技能、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意仪器的使用方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+
 $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥ | B. | ①②③④ | C. | ①②④⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中有CO32- | |
| B. | 向某溶液中加石蕊试液,溶液变蓝,则原溶液中溶质是碱 | |
| C. | 向某溶液中加氢氧化钠溶液,生成蓝色沉淀,则原溶液中有Cu2+ | |
| D. | 向某溶液中加氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,则原溶液中有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 河流三角洲的形成与胶体的性质无关 | |
| B. | 清晨在密林中看到的一缕缕光束,是丁达尔现象的表现 | |
| C. | 向沸水中逐滴加入FeCl3溶液并加热至液体呈透明的红褐色,可得氢氧化铁胶体 | |
| D. | 胶体粒子的直径大小在1~100nm之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com