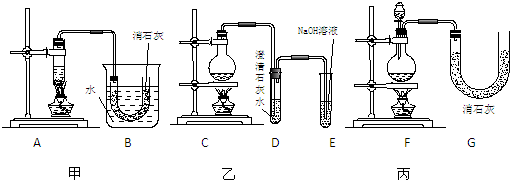
分析:(1)依据化学平衡三段式列式计算,气体压强之比等于气体物质的量之比,反应速率v=
计算 得到,转化率=
×100%;
(2)依据影响化学反应速率的因素分析,升温、增大压强、增大浓度、加入催化剂都可以增大反应速率;
(3)依据反应的特征结合化学平衡移动原理分析,平衡标志是正逆反应速率相同,各组分含量保持不变分析选项.
解答:
解:(1)在一个固定容积为5L的密闭容器中充入等物质的量的SO
2和O
2,半分钟后达到平衡,测得容器内混合气体压强为原压强的0.8倍,且SO
2的物质的量浓度为0.08mol?L
-1.设二氧化硫起始物质的量为x,平衡时二氧化硫物质的量=0.08mol?L
-1 ×5L=0.4mol;
2SO
2(g)+O
2(g)?2SO
3(g)
起始量(mol) x x 0
变化量(mol) x-0.4 0.5(x-0.4)x-0.4
平衡量(mol) 0.4 0.5x+0.2 x-0.4
测得容器内混合气体压强为原压强的0.8倍,则0.4+0.5x+0.2+x-0.4=0.8×2x
x=2mol
则v(O
2)=
=0.32mol/(L?min)
平衡时SO
2的转化率=
×100%=80%;
故答案为:0.32;80%;
(2)①升高温度能加快反应速率,故①正确;
②保持体积不变,只增加氧气的质量,会增大反应物的浓度,反应速率增大,故②正确;
③保持体积不变,充入Ne使体系压强增大,分压不变,平衡不动,速率不变,故③错误;
④保持压强不变,充入Ne使容器的体积增大,压强减小反应速率减小,故④错误;
⑤抽走一些SO
3气体,减小生成物浓度反应速率减小,故⑤错误;
故答案为:①②;
(3)2SO
2(g)+O
2(g)?2SO
3(g)△H=-190kJ?mol
-1,反应是气体体积减小的放热反应;
①当2v(O
2)
正=v(SO
3)
逆 ,说明三氧化硫正逆反应速率相同,反应达到平衡,但v(O
2)
正=2v(SO
3)
逆 ,不能说明反应达到平衡状态,故①错误;
②SO
2、O
2、SO
3的浓度之比为2:1:2,符合反应比,但不能说明正逆反应速率相同,不能说明反应达到平衡状态,故②错误;
③单位时间内生成2n molSO
2的同时生成2n mol SO
3,对二氧化硫或三氧化硫来说,证明正逆反应速率相同,反应达到平衡状态,故③正确;
④反应前后气体质量不变,气体物质的量减小,则容器中气体的平均分子量不随时间而变化能说明反应达到平衡状态,故④正确;
⑤反应前后气体质量和体积始终不变,容器中气体的密度不随时间而变化,不能说明反应达到平衡状态,故⑤错误;
⑥反应前后气体物质的量变化,容器中气体压强不随时间而变化,说明气体物质的量不变,证明反应达到平衡状态,故⑥正确;
⑦SO
2和O
2的物质的量浓度之比不随时间而变化是破坏标志,故⑦正确.
故答案为:③④⑥⑦.