
| A、在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 |
| B、利用太阳能、潮汐能、风力发电,以获取清洁能源 |
| C、大量排放SO2或CO2都会导致酸雨的形成 |
| D、采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 |


科目:高中化学 来源: 题型:
| A、混合前的醋酸约1%发生电离 |
| B、混合后的溶液中c(Na+)=c(CH3COO-) |
| C、氢氧化钠和醋酸的浓度不相等 |
| D、混合后的溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO3在反应中被氧化 |
| B、1mol NaClO3参加反应有2mol电子转移 |
| C、氧化性ClO2>NaClO3 |
| D、氧化产物与还原产物的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1装置制取少量乙酸乙酯 |
| B、图2装置制取并吸收HCl |
| C、图3装置量取8.5mL的稀硫酸 |
| D、图4装置模拟铁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )
如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )| A、a、b不可能是同种材料的电极 |
| B、该装置可能是原电池,电解质溶液为稀盐酸 |
| C、该装置可能是a、b未形成闭合回路,电解质溶液是稀硝酸 |
| D、该装置可能是电解池,电解质溶液为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
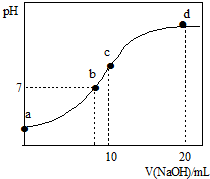 常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com