
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

(1)氢氧燃料电池的能量转化主要形式是___,在导线中电子流动方向为___(用a、b和箭头表示)。
(2)正极反应的电极反应方程式为___。
(3)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

①图1中N型半导体为___(填“正极”或“负极”)
②该系统工作时,A极的电极反应式为___。
③若A极产生7.00gN2,则此时B极产生___LH2(标准状况下)。
【答案】化学能转化为电能 a→b O2+4e-+2H2O=4OH- 负极 CO(NH2)2+8OH--6e-= CO32-+N2↑+6H2O 16.8
【解析】
(1)氢氧燃料电池属于原电池;电子从负极沿导线流向正极;
(2)电解质溶液是碱,正极氧气得到电子生成氢氧根;
(3)根据化合价的变化结合电解池原理判断正负极;电池中,正极发生的反应一定是氧气得电子的过程;根据实际参加反应的氢气以及电极反应式计算。
(1)原电池的实质为化学能转化成电能。电解质溶液是碱,通入氧气的铂电极是正极,电子流动方向与电流流动的方向相反,电流从正极到负极,故电子流向为a→b;
(2)电解质溶液是碱,正极氧气得到电子生成氢氧根,电极反应方程式为:O2+4e-+2H2O=4OH-;
(3)①该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,则图1中N型半导体和B极相连,为负极;
②A是阳极,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,电极方程式为:CO(NH2)2+8OH--6e-= CO32-+N2↑+6H2O;
③根据电子守恒有N2~3H2,则n(H2)=3n(N2)=3×![]() =0.75mol,标况下体积为V(H2)=0.75mol×22.4L/mol=16.8L。
=0.75mol,标况下体积为V(H2)=0.75mol×22.4L/mol=16.8L。


科目:高中化学 来源: 题型:
【题目】下列根据实验现象得出的结论正确的是![]()
选项 | 实验操作 | 现象 | 结论 |
A | 废 | 得到澄清溶液 | X中一定不含 |
B | 浓度均为 | 产生黑色沉淀 |
|
C |
| 试纸变为蓝色 |
|
D |
| 有机相呈橙色 | 氧化性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中粒子浓度关系正确的是( )
A.0.01mol·L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-)
B.![]() =10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12)mol·L-1
=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12)mol·L-1
C.等物质的量的NH4Cl和NaCl的混合溶液:c(NH4)+c(NH3·H2O)+c(Na+)=2c(Cl-)
D.0.1mol·L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车排放的尾气是大气污染气体之一。如何减少污染气体的排放是科学家研究的热门课题。请回答下列问题:
(1)已知:CO的燃烧热为283.0kJ·mol1,N2(g)+2O2(g) =2NO2(g) ΔH=+64kJ·mol1,则NO2(g)+2CO(g)=![]() N2(g)+2CO2(g) ΔH=___kJ·mol1,若反应中有14g还原剂发生反应,则转移电子___mol。
N2(g)+2CO2(g) ΔH=___kJ·mol1,若反应中有14g还原剂发生反应,则转移电子___mol。
(2)使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
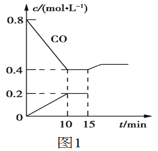
①该反应的化学平衡常数K=___。NO的平衡转化率=___。
②15min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是___。
a.缩小容器体积b.增加CO2的量c.体积不变通入少量氩气d.加入催化剂
③当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是___。
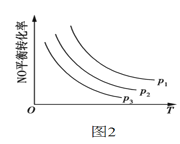
A.该反应ΔH<0 B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大 D.温度不变,增大压强,平衡常数增大
④以下说法中能判断反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)达到平衡的是___。
N2(g)+2CO2(g)达到平衡的是___。
A.反应物和生成物的物质的量相等 B.单位时间内消耗1molNO同时生成1molCO2
C.混合气体压强不再发生变化 D.NO的浓度不再变化
⑤向反应容器中再分别充入下列气体,能使NO转化率增大的是___。
A.O2 B.N2 C.CO D.NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化及解释均正确的是( )
转化 | 解释 | |
A | CuS+H2SO4=CuSO4+H2S↑ | 酸性:H2SO4>H2S |
B | AgCl(s)+I-(aq)AgI(s)+Cl-(aq) | Kap(AgCl)<Kap(AgI) |
C | 2Fe+3Cl2 | 氧化性:Cl2>S |
D | C(s,石墨)=C(s,金刚石) △H=+1.9kJ/mol | 稳定性:石墨 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L Ag2CrO4(相对分子质量332)饱和溶液中,溶有该溶质0.062 57 g,若不考虑离子强度、水解等因素,则Ag2CrO4的Ksp是( )
A.3.2×10-11B.2.36×10-12C.4.24×10-8D.8.74×10-12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+。下列有关说法正确的是( )
CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+。下列有关说法正确的是( )
A.当c(Cu2+)=c(Mn2+)时该反应达到平衡
B.从该反应原理可以得出CuS的溶解度比MnS的溶解度大
C.该反应的平衡常数K=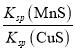
D.往平衡体系中加入少量CuSO4(s)后,c(Mn2+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgCl(s)与AgI(s)分别在溶液中达到沉淀溶解平衡,相关离子浓度的关系如下图所示。下列说法正确的是

A. 曲线Y表示![]() 与
与![]() 的变化关系
的变化关系
B. t℃时,向Z点对应的溶液中加入蒸馏水,可使溶液变为曲线X对应的饱和溶液
C. t℃时,AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=1×106
AgI(s)+Cl-(aq)的平衡常数K=1×106
D. t℃时,向浓度均为0.1mol/ L的KI与KCl混合溶液中加入AgNO3溶液,当Cl-刚好完全沉淀时,此时c(I-) = 1×10-5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com