
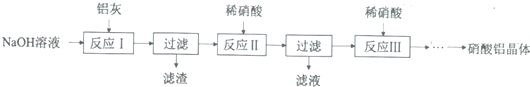
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
分析 铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤分离,滤液中含有偏铝酸钠、未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过减压蒸发得到硝酸铝晶体.
(1)用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌;
(2)硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,应控制硝酸用量,可以利用弱酸将偏铝酸根转化为氢氧化铝沉淀而不溶解;
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干;
(4)产物中杂质NaNO3的含量较高;
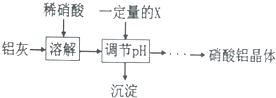
(5)铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去,加入的X能与酸反应切不能引入新杂质;
(6)反应会生成NO,污染空气;
(7)硝酸铝晶体分解得到氧化铝、水,另外物质相当于N2O5,根据Al元素守恒计算硝酸铝的物质的量,结合N原子守恒计算N2O5的质量,可得结晶水的质量,再计算结晶水的物质的量,进而计算结晶水数目.
解答 解:(1)用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,还需要量筒,
故答案为:b;
(2)硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,需要解决的问题是:如何控制反应终点(或硝酸的用量),可以将加入稀硝酸改为通入过量CO2,避免氢氧化铝沉淀溶解,
故答案为:如何控制反应终点(或硝酸的用量);
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干,
故答案为:冷却结晶、洗涤;
(4)反应Ⅱ、Ⅲ合并以简化操作,产物中杂质NaNO3的含量较高,
故答案为:产物中杂质NaNO3的含量较高;
(5)铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去,
加入的X能与酸反应切不能引入新杂质,故不能选氨水、偏铝酸钠,可以选择Al与氢氧化铝,
故答案为:将Fe3+转化为Fe(OH)3沉淀除去;BC;
(6)Al与稀硝酸反应会生成NO,污染空气,
故答案为:产生大量污染性气体NO等;
(7)硝酸铝晶体分解得到氧化铝、水,另外物质相当于N2O5,氧化铝的物质的量为$\frac{1.02g}{102g/mol}$=0.01mol,根据Al元素守恒,硝酸铝的物质的量为0.02mol,根据N原子守恒,可知N2O5为$\frac{0.02mol×3}{2}$=0.03mol,其质量为0.03mol×108g/mol=3.24g,故结晶水为质量为7.392g-1.02g-3.24g=3.132g,结晶水物质的量为$\frac{3.132g}{18g/mol}$=0.174mol,故结晶水数目为$\frac{0.174mol}{0.02mol}$=8.7,
故答案为:8.7.
点评 本题考查实验制备方案,侧重考查是对工艺流程的理解、分析与评价以及化学计算,是对学生综合能力的考查,需要学生具备知识的基础与灵活运用的能力,(7)中计算为易错点,学生不清楚发生的反应导致无法计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中含阴、阳离子总数是0.6NA | |
| B. | 500mL溶液中Βa2+的浓度是0.2mol•L-1 | |
| C. | 500mL溶液中NO-3的浓度是0.4mol•L-1 | |
| D. | 1L溶液中含有0.2NA个NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯的实验室制备主要步骤如下:
硝基苯的实验室制备主要步骤如下: .
. +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
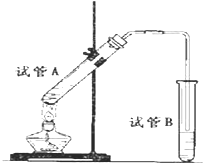 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
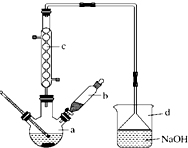 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | +2(a-b-c) kJ•mol-1 | B. | +2(b-a) kJ•mol-1 | ||
| C. | +(b+c-a) kJ•mol-1 | D. | +(a+b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
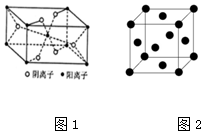 W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:
W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com