
 ;
;分析 A、B、C、D、E属于短周期元素,原子序数依次增大,高纯度的D单质可制造芯片,C、D的单质都能与强碱溶液反应,C的简单离子半径是同周期所有离子中最小的,则D为Si,C为Al;B、C、D、E同周期,所以B、C、D、E在第三周期,A与B可形成两种离子化合物甲和乙,A与E同主族,E的原子序数大于Si,且在甲中氧离子与钠离子的电子层结构相同,可推知A为氧,B为钠,E为硫,甲为氧化钠(Na2O),乙为过氧化钠(Na2O2 ),据此解答.
解答 解:A、B、C、D、E属于短周期元素,原子序数依次增大,高纯度的D单质可制造芯片,C、D的单质都能与强碱溶液反应,C的简单离子半径是同周期所有离子中最小的,则D为Si,C为Al;B、C、D、E同周期,所以B、C、D、E在第三周期,A与B可形成两种离子化合物甲和乙,A与E同主族,E的原子序数大于Si,且在甲中氧离子与钠离子的电子层结构相同,可推知A为氧,B为钠,E为硫,甲为氧化钠(Na2O),乙为过氧化钠(Na2O2 ).
(1)由上述分析可知,A为O元素,D为Si元素,故答案为:O;Si;
(2)乙为Na2O2,含有离子键、共价键,故答案为:Na2O2;离子键、共价键;
(3)E为硫元素,有3个电子层,最外层有6个电子,处于第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
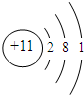
(4)B为钠,Na有3个电子层,最外层1个电子,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(5)Al与氢氧化钠、水反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)Al在工业上常做还原剂,由于冶炼金属,比如Al与氧化铁反应,化学反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查结构性质位置关系综合应用,涉及元素化合物推断、核外电子排布、化学键、方程式书写等,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,甲酸溶液比盐酸溶液的导电性弱 | |
| B. | 甲酸能与NaHCO3作用放出CO2气体 | |
| C. | 等体积、等物质的量浓度甲酸溶液与NaOH溶液混合时恰好完全中和 | |
| D. | 室温下,1mol/L的甲酸溶液的pH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和苯 | |
| B. | 用碳酸氢钠溶液鉴别乙酸和乙醇 | |
| C. | 用新制的氢氧化铜悬浊液鉴别葡萄糖和蔗糖 | |
| D. | 用溴的四氯化碳溶液鉴别裂解气和焦炉气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com