氮氧化物(NO
x)、SO
2和CO
2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NO
x:
CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H
1=-574kJ?mol
-1CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H
2=-1160kJ?mol
-1甲烷直接将NO
2还原为N
2的热化学方程式为
.
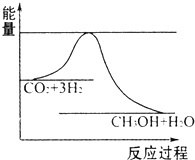
(2)脱碳.将CO
2转化为甲醇:CO
2(g)+3H
2(g)═CH
3OH(g)+H
2O(g)△H
3
在一恒温恒容密闭容器中充入1mol CO
2和3mol H
2进行上述反应.测得CO
2和
CH
3OH(g)浓度随时间变化如图1所示.则0~10min内,氢气的平均反应速率为
mol/(L?min);第10min后,保持温度不变,向该密闭容器中再充入1mol CO
2(g)
和1mol H
2O(g),则平衡
(填“正向”、“逆向”或“不”)移动.
(3)脱硫.利用Na
2SO
3溶液可脱除烟气中的SO
2.Na
2SO
3可由NaOH溶液吸收SO
2制
得.NaOH溶液吸收SO
2的过程中,pH随n(SO
32-):n(HSO
3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO
3溶液显
性,用化学平衡原理解释:
.
②当溶液呈中性时,离子浓度关系正确的是(选填字母):
.
a.c(Na
+)=2c(SO
32-)+c(HSO
3-)
b.c(Na
+)>c(HSO
3-)>c(SO
32-)>c(H
+)=c(OH
-)
c.c(Na
+)+c(H
+)=c(SO
32-)+c(HSO
3-)+c(OH
-)
(4)利用如图2所示装置(电极均为惰性电极)可吸收SO
2,用阴极排出的溶液可吸收NO
2.
①阳极的电极反应式为
.
②在碱性条件下,用阴极排出的溶液吸收NO
2,使其转化为无害气体,同时有SO
32-生成.该反应中氧化剂与还原剂的物质的量之比为
.




 国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:
国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:
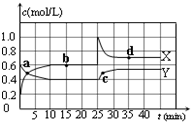 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.