
| A. | 7.5 L | B. | 12.3 L | C. | 15.7 L | D. | 16.8 L |
分析 利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=$\frac{m}{M}$计算n(CuO),根据电子转移守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒,计算n(NO)、n(NO2),根据V=nVm计算气体体积,实际气体介于二者之间.
解答 解:若混合物全是CuS,其物质的量n(CuS)=n(CuO)=$\frac{12g}{80g/mol}$=0.15mol,转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO的物质的量为x、NO2的物质的量为x,则3x+x=1.2,解得x=0.3,故气体体积V=0.6mol×22.4L/mol=13.44L;
若混合物全是Cu2S,其物质的量n(Cu2S)=$\frac{1}{2}$n(CuO)=$\frac{1}{2}$×0.15mol=0.075mol,转移电子物质的量0.075×10=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,解得x=0.1875,气体体积0.1875mol×2×22.4L/mol=8.4L,
故8.4L<V<13.44L,只有B符合,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握极限法及电子守恒为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 醋酸铵与稀盐酸反应:CH3COONH4+H+→CH3COOH+NH4+ | |
| B. | 氯化铁溶液中通入硫化氢气体:2Fe3++S2-→2Fe2++S↓ | |
| C. | 硫酸铜溶液中加入过量的氢氧化钡:Ba2++SO42-→BaSO4↓ | |
| D. | 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-→6Cl-+2Fe3++2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
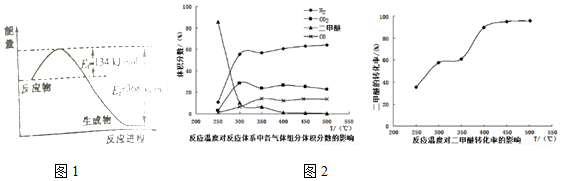
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
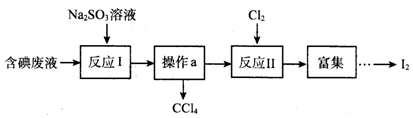
| A. | 操作a的名称为蒸馏 | |
| B. | 反应I、II中碘元素均被氧化 | |
| C. | 还原性强弱顺序:SO32->I->Cl- | |
| D. | 若反应I消耗25.2g Na2SO3,则反应II消耗标准状况下氯气的体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol | B. | 0.6 mol | C. | 0.4 mol | D. | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.4g | B. | 14.8g | C. | 205g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$Fe+4CO2 | B. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com