
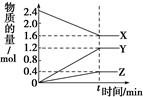
| A.到达t时刻该反应已停止 |
| B.在t时刻之前X的消耗速率大于它的生成速率 |
| C.在t时刻正反应速率等于逆反应速率 |
| D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等 |
 3Y+Z(写“ = ”扣1分)
3Y+Z(写“ = ”扣1分)  3Y+Z。
3Y+Z。 ,所以Y的平均反应速率是0.6/tmol·(L·min)-1。
,所以Y的平均反应速率是0.6/tmol·(L·min)-1。

科目:高中化学 来源:不详 题型:单选题
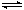 2Z(g) 此反应达到平衡的标志是( )
2Z(g) 此反应达到平衡的标志是( )| A.正反应和逆反应的速率都为零 | B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶2∶2 | D.单位时间消耗0.1molX同时生成0.2molZ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
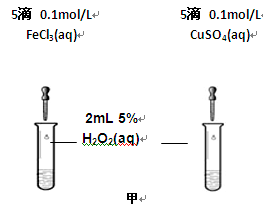
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
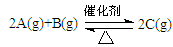 过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |
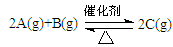 的正反应△H (填“大于”或“小于”)0。
的正反应△H (填“大于”或“小于”)0。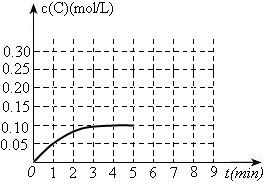
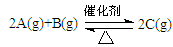 的平衡常数K= 。
的平衡常数K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是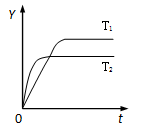
| A.N2的转化率 | B.混合气体的密度 |
| C.密闭容器的压强 | D.H2的体积分数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3,已达平衡状态的是( )
2NH3,已达平衡状态的是( )| A.1个N≡N键断裂的同时有6个H-N键形成 |
| B.1个N≡N键断裂的同时有3个H-H键形成 |
| C.容器内各物质的浓度相等 |
| D.容器内N2、H2、NH3的速率之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
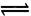 I3一(aq)。测得不同温度下该反应的平衡常数值如下表:
I3一(aq)。测得不同温度下该反应的平衡常数值如下表:| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
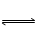 I3-(aq)的△H>0
I3-(aq)的△H>0 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
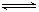 ?2NH3在t1时刻达到平衡;t2时刻再从A口快速充入一定量NH3,封闭A;t3时刻重新达到平衡至t4。在0→t4时间内混合气中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )
?2NH3在t1时刻达到平衡;t2时刻再从A口快速充入一定量NH3,封闭A;t3时刻重新达到平衡至t4。在0→t4时间内混合气中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )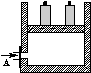
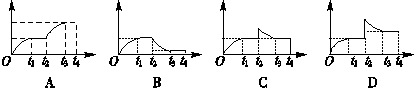
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B.光照氯水,颜色变浅 |
| C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的转化率 |
| D.由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com