
| A. | 若溶液呈中性,则c(K+)=c(CH3COO-) | |
| B. | 若溶液呈碱性,则c(K+)>c(CH3COO-) | |
| C. | 若溶液呈酸性,则c(H+)>c(CH3COO-)>c(K+) | |
| D. | 溶液呈电中性,则c(H+)+c(K+)=c(CH3COO-)+c(OH-) |
分析 溶液中仅含有K+、H+、CH3COO-、OH-四种离子,溶液中溶质的组成可以是:①CH3COOK、②CH3COOK和CH3COOH、③CH3COOK和KOH,溶液中存在CH3COO-+H2O?CH3COOH+OH-以及醋酸的电离,
A.若溶液为中性,则c(H+)=c(OH-),根据电荷守恒判断;
B.若溶液为碱性,则c(H+)<c(OH-),根据电荷守恒可知c(K+)>c(CH3COO-);
C.若溶液为酸性,溶质应该为CH3COOK和CH3COOH,由于醋酸为弱酸,电离程度较小,则c(CH3COO-)>c(H+);
D.根据溶液中的电荷守恒判断.
解答 解:A.若溶液为中性,则c(H+)=c(OH-),根据电荷守恒c(H+)+c(K+)=c(CH3COO-)+c(OH-)可知:c(K+)=c(CH3COO-),故A正确;
B.若溶液为碱性,则c(H+)<c(OH-),根据电荷守恒c(H+)+c(K+)=c(CH3COO-)+c(OH-)可知:c(K+)>c(CH3COO-),故B正确;
C.若溶液为酸性,则c(H+)>c(OH-),溶质应该为CH3COOK和CH3COOH,由于醋酸为弱酸,电离程度较小,则c(CH3COO-)>c(H+),溶液中正确的离子浓度大小为:c(CH3COO-)>c(H+)>c(K+),故C错误;
D.溶液中一定存在电荷守恒:c(H+)+c(K+)=c(CH3COO-)+c(OH-),故D正确;
故选C.
点评 本题考查了离子浓度大小比较、弱电解质的电离平衡及其影响,题目难度中等,注意掌握弱电解质的电离平衡及其影响因素,明确电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题
 $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$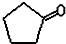
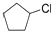
 .
.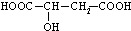
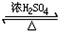 CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O
CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
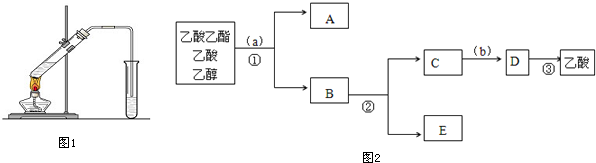
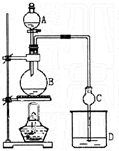 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物:CH2O2、C2H4O2、C3H6O2 | B. | 化合物:五水硫酸铜、烧碱、冰醋酸 | ||
| C. | 电解质:Al2O3、NaOH、CaCO3 | D. | 同素异形体:金刚石、石墨、足球烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和Na2CO3溶液 | B. | CaCl2溶液 | C. | Na2SiO3溶液 | D. | Ca(ClO)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4g CH4含有NA个C-H共价键 | |
| B. | 1 mol Fe与过量的稀硝酸反应过程中转移的电子数为2NA | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IVA族元素氢化物熔点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物熔点顺序也是:AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 工业上用电解氯化镁制备镁单质,工业上也可用电解氯化铝制备铝单质 | |
| D. | Fe3O4可改写成氧化物的形式为:FeO•Fe2O3;因此Pb3O4也可改写为:PbO•Pb2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 充电过程中OH-离子从阳极向阴极迁移 | |
| C. | 充电过程中阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原 | |
| D. | NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com