
| 成分 | SiO2 | MgO | Fe2O3 | Al2O3 | CuO |
| 质量分数(%) | ? | 4.0 | 32 | 10.2 | 16 |
| Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
| 完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |
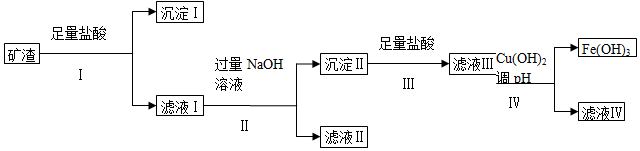
分析 矿渣加入足量盐酸,SiO2不溶,过滤得到沉淀Ⅰ为SiO2,滤液中含有MgCl2、AlCl3、FeCl3、CuCl2,加过量的NaOH后Al3+转化为NaAlO2,MgCl2、FeCl3、CuCl2反应生成Mg(OH)2沉淀、Fe(OH)3沉淀、Cu(OH)2沉淀,过滤得到滤液Ⅱ为NaAlO2溶液,沉淀Ⅱ为Mg(OH)2沉淀、Fe(OH)3沉淀、Cu(OH)2沉淀,加盐酸反应生成MgCl2、FeCl3、CuCl2,加入Cu(OH)2控制pH值大于3.7小于4.8,使三价铁离子转化为Fe(OH)3沉淀,
(1)沉淀Ⅰ是二氧化硅,二氧化硅是制造光导纤维的主要材料;步骤Ⅳ中调节pH使铁离子生成沉淀而铜离子、镁离子不生成沉淀;
(2)滤液Ⅱ的主要成分是偏铝酸钠,偏铝酸钠能和二氧化碳反应生成氢氧化铝沉淀,氢氧化铝分解生成氧化铝;
(3)由滤液Ⅰ中铝离子和过量NaOH反应生成可溶性的偏铝酸钠;
(4)滤液Ⅳ中含有的金属阳离子是镁离子、铜离子;
(5)较活泼金属采用电解法、Fe和Cu采用热氧化还原反应法冶炼,电解时电解熔融氯化物或氧化物,热氧化还原法冶炼金属用金属氧化物.
解答 解:矿渣加入足量盐酸,SiO2不溶,过滤得到沉淀Ⅰ为SiO2,滤液中含有MgCl2、AlCl3、FeCl3、CuCl2,加过量的NaOH后Al3+转化为NaAlO2,MgCl2、FeCl3、CuCl2反应生成Mg(OH)2沉淀、Fe(OH)3沉淀、Cu(OH)2沉淀,过滤得到滤液Ⅱ为NaAlO2溶液,沉淀Ⅱ为Mg(OH)2沉淀、Fe(OH)3沉淀、Cu(OH)2沉淀,加盐酸反应生成MgCl2、FeCl3、CuCl2,加入Cu(OH)2控制pH值大于3.7小于4.8,使三价铁离子转化为Fe(OH)3沉淀,
(1)沉淀Ⅰ是二氧化硅,二氧化硅是制造光导纤维的主要材料;步骤Ⅳ中调节pH使铁离子生成沉淀而铜离子、镁离子不生成沉淀,根据表中数据知,要使三价铁离子沉淀,铜离子、镁离子不沉淀,则需满足pH值大于3.7小于4.8;
故答案为:制光导纤维;大于3.7小于4.8;
(2)偏铝酸钠溶液中通入二氧化碳可生成氢氧化铝和碳酸氢钠,氢氧化铝受热分解生成氧化铝和水,反应方程式:NaAlO2+CO2+H2O═NaHCO3+Al(OH)3↓,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
故答案为:CO2;NaAlO2+CO2+H2O═NaHCO3+Al(OH)3↓,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(3)氯化铝与足量氢氧化钠反应生成偏铝酸钠和水、氯化钠,离子方程式:Al3++4OH-═AlO2-+2H2O;
故答案为:Al3++4OH-═AlO2-+2H2O;
(4)滤液Ⅲ中含有镁离子、铜离子、三价铁离子,加入氢氧化铜调节pH值大于3.7小于6.4,则三价铁离子全部转化为氢氧化铁沉淀,所以滤液Ⅳ中含有离子为:Mg2+、Cu2+;
故答案为:Mg2+、Cu2+;
(5)较活泼金属采用电解法、Fe和Cu采用热氧化还原反应法冶炼,电解时电解熔融氯化物或氧化物,热氧化还原法冶炼金属用金属氧化物,Mg、Al为较活泼金属,采用电解法冶炼,Fe、Cu采用热氧化还原法冶炼,电解熔融 Al2O3冶炼Al、电解熔融MgCl2冶炼Mg、热氧化还原Fe2O3冶炼Fe、热氧化还原CuO冶炼Cu,
故答案为:B; Al2O3;Fe2O3;CuO;MgCl2.
点评 本题考查物质制备,为高频考点,侧重考查学生对元素化合物性质、物质分离和提纯等知识点的掌握和灵活运用,明确元素化合物性质及其差异性、物质分离提纯方法、金属冶炼方法是解本题关键,注意:Al不能采用电解氯化铝的方法冶炼,必须采用电解氧化铝的方法冶炼.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 硝酸银与盐酸反应:AgNO3+Cl-═NO3-+AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


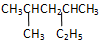 的系统命名是:2,4-二甲基己烷
的系统命名是:2,4-二甲基己烷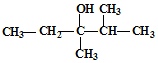 的键线式是
的键线式是
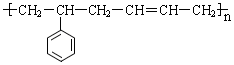 的单体结构简式为:
的单体结构简式为: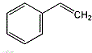 和CH2=CH-CH=CH2
和CH2=CH-CH=CH2

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中可能发生反应Z2+2A2+=2A3++2Z- | |
| B. | Z2在①③反应中作还原剂 | |
| C. | 氧化性强弱顺序为XO4->Z2>B2>A3+ | |
| D. | X2+是XO4-的还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol/L NaCl溶液 | B. | 75mL2mol/L NH4Cl溶液 | ||
| C. | 150mL3mol/L KCl溶液 | D. | 75mL1mol/L CuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>H2O>HF | B. | 熔点:金刚石>碳化硅>晶体硅 | ||
| C. | 硬度:白磷>冰>二氧化硅 | D. | 熔点:SiI4<SiBr4<SiCl4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com