
【题目】某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法不正确的是
(已知:Ksp(ZnS)=3×10-25mol2/L2)

A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+)
C.该温度下Ksp(CuS)=10-35.4 mol2/L2
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Cu2+先沉淀
【答案】A
【解析】
A. b点为CuCl2溶液与Na2S恰好完全反应的点,溶质为氯化钠,氯化钠不水解, a点CuCl2有剩余,Cu2+水解、c点Na2S有剩余,S2-水解,所以b点水的电离程度最小,故A错误;
B. 根据物料守恒,Na2S溶液中2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故B正确;
C. b点为CuCl2溶液与Na2S恰好完全反应的点,根据图示,b点Cu2+浓度均为10-17.7 mol/L 、S2-浓度为10-17.7 mol/L,该温度下Ksp(CuS)=10-35.4 mol2/L2,故C正确;
D. Ksp(ZnS)>Ksp(CuS),向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Cu2+先沉淀,故D正确。
答案选A。


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】在煤的化工生产中,我们常常需要研究不同温度下的平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表,
H2(g)+CO2(g)的平衡常数随温度的变化如下表,
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数/K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_________(填“增大”、“减小”或“不变”),容器内混合气体的压强___________(填“增大”、“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有_______________(选填字母)。
投料 | A | B | C | D |
n(CO2)/mol | 3 | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2 | 5 | 2 | 3 | 2 |
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g),2min达到平衡时,CO的转化率为____________,用CO2表示的平均反应速率V(CO2)为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性联氨燃料电池具有能量密度较高和无污染等特点,其工作原理如下图所示,下列说法不正确的是

A.负极反应:N2H4-4e-=4H++N2↑
B.通入氧气的电极为正极
C.电池工作时OH-向负极移动
D.该电池工作一段时间后,电解质溶液碱性不变(不考虑电解质溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(CH3COONa)<c(NaHCO3)
B.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.3 mol·L-1 NaCl溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L-1
C.25℃时,0.1 mol·L-1 Na2CO3溶液中水电离出来的c(OH)大于0.1 mol·L-1 NaOH溶液中水电离出来的c(OH-)
D.浓度均为0.1 mol/L的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(CH2COOH)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=___________。
2CO2(g)+N2(g) △H=___________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=2MPa,则T℃时该反应的压力平衡常数Kp=___________;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,平衡将___________ (填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是___________(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为___________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为___________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.11g基态硼原子含有的未成对电子数为3NA
B.1mol基态氟原子能量最高的能级上电子数为7NA
C.100mL1molL-l亚硫酸钠溶液含有的阴离子数目大于0.1NA
D.电解法精炼铜,阴极析出64gCu时,阳极转移的电子数大于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是极具发展潜力的清洁能源,氢气的开发和综合利用是目前全球重要的科研项目之一。回答下列问题:
(1)T℃时,向体积均为1L的甲、乙两个恒容容器中分别加入足量碳和0.1molH2O(g),发生反应:H2O(g)+C(s)CO(g)+H2(g) △H>0。甲容器控制绝热条件,乙容器控制恒温条件,两容器中压强随时间的变化如图所示。
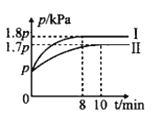
①图中代表甲容器的曲线为__(填“Ⅰ”或“Ⅱ”)。
②下列关于甲容器反应体系的说法错误的是__。
A.当水蒸气的体积分数不再发生变化,反应达到平衡状态
B.从密闭容器中分离出部分固体碳,H2的体积分数减小
C.缩小容器体积,平衡逆向移动,平衡常数减小
D.向平衡体系中充入少量水蒸气,再次平衡后,容器中c(CO)增大
③乙容器中,从反应开始到达平衡,v(H2O)=__molL-lmin-l;T℃下,该反应的平衡常数Kp=___(用含p的代数式表示)。
(2)对于反应aA(g)+bB(g)cC(g)+dD(g),速率方程v═kcm(A)cn(B),k为速率常数(只受温度影响),m+n为反应级数。已知H2(g)+CO2(g)CO(g)+H2O(g),CO的瞬时生成速率=kcm(H2)c(CO2)2。一定温度下,控制CO2起始浓度为0.25molL-1,改变H2起始浓度,进行以上反应的实验,得到CO的起始生成速率和H2起始浓度呈如图所示的直线关系。
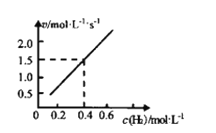
①该反应的反应级数为__。
②速率常数k=__。
③当H2的起始浓度为0.2molL-1,反应进行到某一时刻时,测得CO2的浓度为0.2molL-1,此时CO的生成瞬时速率v=__molL-ls-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )
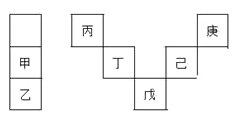
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物为分子晶体,可用于制造光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com