
【题目】已知:在无氧条件下,葡萄糖发生反应C6H12O6![]() 2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
A.0.1 mol葡萄糖(C6H12O6)含羟基(-OH)数目为0.6NA
B.常温常压下,46 g CH3CH2OH与足量的钠反应产生氢分子数为0.5NA
C.4.48 L CO2和CO的混合气体所含碳原子总数为0.2NA
D.2.4 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
【答案】B
【解析】
A.1个葡萄糖分子中含有5个-OH,则0.1 mol葡萄糖(C6H12O6)中含羟基(-OH)数目为0.5NA,A错误;
B.46 g CH3CH2OH的物质的量是1 mol,由于2 molCH3CH2OH与足量金属钠反应产生1 mol H2,则1 mol CH3CH2OH与足量的钠反应产生氢分子的物质的量是0.5 mol,分子数为0.5NA,B正确;
C.缺少外界条件,不能确定气体的物质的量,因此不能计算其中含有的C原子数目,C错误;
D.Mg是+2价金属,1 mol Mg完全失去2 mol电子,2.4 g Mg的物质的量是0.1 mol,则其在足量的CO2中完全燃烧,转移电子数目为0.2NA,D错误;
故合理选项是B。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
. 无论x为何值,两容器中达平衡时w(HI)%均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g),已达到平衡状态的是( )
C(g)+D(g),已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧B. ①③④⑤
C. ①②③④⑤⑦D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用钛精矿(主要成分TiO2,矿粉中含有Fe,Al,Si,V等氧化物)制备海绵钛的基本思路是:氯化法生产TiCl4、还原、真空蒸馏法制备海绵钛(Ti)。
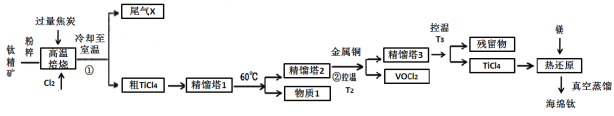
已知:①氯化过程中,其他元素均转化为最高价氯化物;
②热还原过程中,可能会有副产物TiCl3;
③常见物质熔沸点
化合物 | TiCl4 | SiCl4 | FeCl3 | AlCl3 | VOCl3 | VOCl2 | MgCl2 | Ti | Mg |
沸点 | 136 | 56 | 308 | 180(升华) | 134 | 168 | 1412 | 3260 | 1090 |
熔点 | -69 | -25 | 304 | 190 | -78.9 | —— | 712 | 1668 | 648.9 |
回答下列问题:
(1)将钛精矿粉粹的目的是:_______________
(2)氯化过程中,TiO2发生的化学方程式①是:_____________
(3)物质1是________,步骤②中金属铜的作用是将VOCl3还原成VOCl2,其目的是_____________;
(4)工业上常用Mg或H2作还原剂,在Ar气氛下采用热还原法制海绵钛。
①镁不足时,TiCl4会因有副产物产生而导致产率会下降,副反应的化学方程式为_____________;此处采用真空蒸馏法除去海绵钛中的Mg和MgCl2,不采用常压蒸馏的原因是_______。
②根据图象,计算1173K时,反应2H2+TiCl4 =Ti+4HCl的△G=_________。
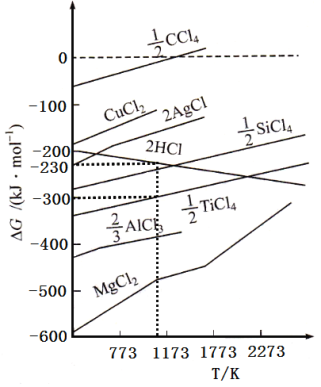
(G为自由能,图中△G是指在一定温度下,由单质生成对应物质的量化合物时的自由能变化。设此温度下,单质的生成自由能变化为0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的A、B、C、D表示元素周期表中的四个区域:
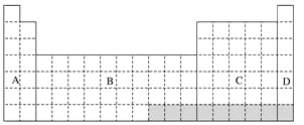
(1)全部是金属元素的区域为____________。
(2)短周期甲元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,甲的原子序数是________。
(3)短周期乙元素的原子核外第三层电子数与第一层电子数相等,则乙元素位于元素周期表的第_______周期第______族。
(4)用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验(a、b电极均为Ag单质),观察到了灵敏电流计指针发生偏转。下列说法正确的是
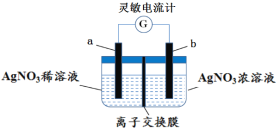
A.b极电极反应式为Ag–e–= Ag+
B.离子交换膜为阴离子交换膜
C.去掉离子交换膜,电流表仍然有电流通过
D.电流计指针不再偏转时,右边硝酸银溶液的物质的量浓度依然大于左边
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧热是指在25℃,101kPa,1mol可燃物完全燃烧生成稳定的化合物时放出的热量。已知热化学方程式:①CO(g)+1/2 O2(g)=CO2(g) ΔH= -283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8kJ·mol-1
则下列说法正确的是
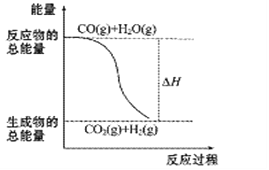
A. H2的燃烧热为241.8 kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l) ΔH> -241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津大学某科研团队创新地提出了一种基于电化学冶金原理并利用电解质去耦合策略,在电池中同时进行MnO2和Zn可逆溶解/电沉积的储能机制,其工作原理如图,电池放电总反应为Zn+4OH-+MnO2+4H+![]() Zn(OH)
Zn(OH)![]() +Mn2++2H2O。下列说法不正确的是( )
+Mn2++2H2O。下列说法不正确的是( )
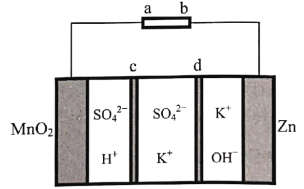
A.充电时,Zn电极区为阴极区
B.c为阴离子交换膜,d为阳离子交换膜
C.放电时,正极电极反应式为MnO2+4H++2e-=+Mn2++2H2O
D.充电时,电子的流向为a→MnO2→电解质溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中不正确的是( )
A.小苏打是面包发酵粉的主要成分之一
B.侯氏制碱法的工艺过程中应用了物质溶解度的差异
C.用酚酞溶液可鉴别饱和食盐水和饱和纯碱溶液
D.NaHCO3的热稳定性大于Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com