
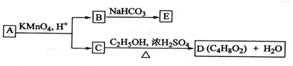
| A. | B的结构简式为HOOC-CH2-COOH | |
| B. | C与乙醇发生了酯化反应 | |
| C. | A的结构简式是CH3-CH(OH)-CH=CH-CH3 | |
| D. | E的分子式为C3H2O4Na2 |
分析 A的分子式为C5H10O,不饱和度为$\frac{2×5+2-10}{2}$=1,被酸性高锰酸钾氧化生成B、C,由信息可知,A含有1个C=C双键,B、C都含有羧基,C与乙醇发生酯化反应生成D为C4H8O2,则C为CH3COOH、D为CH3COOC2H5.B中碳原子数目为3,能与碳酸氢钠按1:2反应,故B分子中含有2个羧基-COOH,说明A分子中还含有1个-OH,故A的结构简式为CH3CH=CHCH2CH2OH、则B为HOOCCH2COOH,与碳酸氢钠反应生成E为NaOOCCH2COONa,据此进行解答.
解答 解:A的分子式为C5H10O,不饱和度为$\frac{2×5+2-10}{2}$=1,被酸性高锰酸钾氧化生成B、C,由信息可知,A含有1个C=C双键,B、C都含有羧基,C与乙醇发生酯化反应生成D为C4H8O2,则C为CH3COOH、D为CH3COOC2H5.B中碳原子数目为3,能与碳酸氢钠按1:2反应,故B分子中含有2个羧基-COOH,说明A分子中还含有1个-OH,故A的结构简式为CH3CH=CHCH2CH2OH、则B为HOOCCH2COOH,与碳酸氢钠反应生成E为NaOOCCH2COONa,
A.由上述分析可知,B为HOOCCH2COOH,故A正确;
B.C含有羧基,与乙醇发生酯化反应,故B正确;
C.A的结构简式为CH3CH=CHCH2CH2OH,故C错误;
D.E为NaOOCCH2COONa,分子式为C3H2O4Na2,故D正确;
故选C.
点评 本题考查有机物的推断,题目难度中等,需要学生对给予的信息进行利用,注意掌握常见有机物官能团的性质与转化,试题综合考查学生分析和运用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等物质的量的物质燃烧所消耗O2的量:环已烷>苯>苯甲酸 | |
| B. | 密度:CCl4>H2O>乙酸乙酯 | |
| C. | 相等质量的物质燃烧所消耗O2的量:乙炔>乙烯>乙烷 | |
| D. | 熔点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中所有的族都是由长、短周期的元素共同组成 | |
| B. | 最外层电子数相同的元素不一定都是同一族 | |
| C. | 非金属元素都是主族元素,金属元素都是副族元素 | |
| D. | 元素周期表中共有18个纵行,每个纵行都是一个族,共有18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
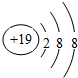
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

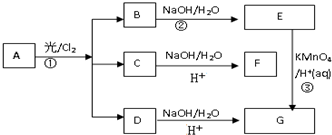
 .
.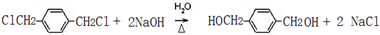 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K+、OH-、SO42-、SCN- | |
| B. | 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3- | |
| C. | c(OH-)=1mol/L的溶液中:Na+、K+、CO32-、NO3- | |
| D. | c(H+)=1mol/L的溶液中:K+、Na+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com