
分析 (1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=$\frac{1}{2}$(△H1+
△H2);
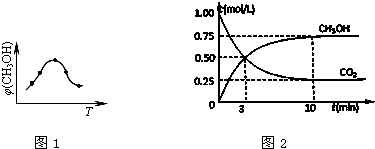
(2)①由图可知最高点反应到达平衡,到达平衡后,温度越高,φ(CH3OH)越小,升高平衡向逆反应进行;
②由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,开始CO2的浓度为1mol/L,故容器的体积为$\frac{1mol}{1mol/L}$=1L,H2的起始浓度为$\frac{3mol}{1L}$=3mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
根据v=$\frac{△c}{△t}$计算v(H2);平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
第10min后,向该容器中再充入1mol CO2和3mol H2,等效为在原平衡的基础上增大压强,平衡正向移动;
(3)①溶液中铵根离子水解:NH4++H2O?NH3•H2O+H+,破坏水的电离平衡,溶液呈酸性,
室温下,a mol/L的(NH4)2SO4水溶液的pH=5,溶液中c(H+)=10-5mol/L,溶液中氢离子源于铵根离子水解及水的电离,故溶液中c(NH3•H2O)=c(H+)-c(OH-)=(10-5-10-9)mol/L,溶液中c(NH4+)=2amol/L-(10-5-10-9)mol/L=(2a+10-9-10-5 )mol/L,代入Kh=$\frac{c(N{H}_{3}•{H}_{2}O)×c({H}^{+})}{c(N{{H}_{4}}^{+})}$计算;
②根据电荷守恒:c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-).
解答 解:(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=$\frac{1}{2}$(△H1+
△H2)=-867kJ/mol,
反应热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,
故答案为:<;
②由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,开始CO2的浓度为1mol/L,故容器的体积为$\frac{1mol}{1mol/L}$=1L,H2的起始浓度为$\frac{3mol}{1L}$=3mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故0~10min内v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•min);
平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$;
第10min后,向该容器中再充入1mol CO2和3mol H2,等效为在原平衡的基础上增大压强,平衡正向移动,则再次达到平衡时CH3OH(g)的体积分数增大,
故答案为:0.225mol/(L•min);$\frac{16}{3}$;增大;
(3)①溶液中铵根离子水解:NH4++H2O?NH3•H2O+H+,破坏水的电离平衡,溶液呈酸性,
室温下,a mol/L的(NH4)2SO4水溶液的pH=5,溶液中c(H+)=10-5mol/L,溶液中氢离子源于铵根离子水解及水的电离,故溶液中c(NH3•H2O)=c(H+)-c(OH-)=(10-5-10-9)mol/L,溶液中c(NH4+)=2amol/L-(10-5-10-9)mol/L=(2a+10-9-10-5 )mol/L,则平衡常数Kh=$\frac{c(N{H}_{3}•{H}_{2}O)×c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{1{0}^{-5}×(1{0}^{-5}-1{0}^{-9})}{(2a+1{0}^{-9}-1{0}^{-5})}$,
故答案为:NH4++H2O?NH3•H2O+H+;$\frac{1{0}^{-5}×(1{0}^{-5}-1{0}^{-9})}{(2a+1{0}^{-9}-1{0}^{-5})}$;
②根据电荷守恒:c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-),则溶液中c(Na+)+c(H+)<c(NO3-)+c(OH-),故答案为:<.
点评 本题考查化学平衡计算与影响因素、热化学方程式、盐类水解等,培养了学生分析问题解决问题的能力,需要学生具备扎实的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷$\stackrel{NaOH/水}{→}$乙醇$\stackrel{浓硫酸}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| B. | 溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| C. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{HBr}{→}$溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| D. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 曲线Ⅱ对应的条件改变是减小压强 | |
| B. | 若T2℃时,上述反应平衡常数为0.42,则T2<T1 | |
| C. | 在T1℃时,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) | |
| D. | 在T1℃时,若起始时向容器中充入4.5molCO2、6mol H2,平衡时容器内压强P=$\frac{{P}_{1}}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:
在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 醋酸溶液 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 25.0 | 25.1 | 27.8 |
| 2 | 25.1 | 25.3 | 27.9 |
| 3 | 25.2 | 25.5 | 28.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X、Y和Z均能使溴水褪色 | |
| B. | Y可作加聚反应单体,X可作缩聚反应单体 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | X和Z均能与Na2CO3溶液反应放出CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com