
| A. | 键的极性:H2O>H2S | B. | 导电性:HF溶液<HCl溶液 | ||
| C. | 燃烧热:△H(C)(s,石墨)>△H(CO)(g) | D. | 耐腐蚀性:铝<生铁 |
分析 A.形成共价键的两种元素的非金属性差别越大,则形成的共价键的极性越大;
B.溶液的导电性与离子浓度有关;
C.燃烧反应的△H为负值;
D.Al的表面能形成致密的氧化膜,Fe能形成疏松的氧化膜.
解答 解:A.形成共价键的两种元素的非金属性差别越大,则形成的共价键的极性越大,已知非金属性:O>S,则键的极性:H2O>H2S,故A正确;
B.溶液的导电性与离子浓度有关,不能确定HF和HCl中离子浓度的大小关系,所以不能确定HF溶液与HCl溶液的导电性强弱,故B错误;
C.燃烧反应的△H为负值,1molC燃烧放出的热量大于1molCO燃烧放出的热量,所以燃烧热:△H(C)(s,石墨)<△H(CO)(g),故C错误;
D.Al的表面能形成致密的氧化膜,能保护内部金属不被极性氧化,而Fe形成疏松的氧化膜,不能保护内部金属,所以耐腐蚀性:铝>生铁,故D错误.
故选A.
点评 本题考查了化学键的极性、溶液的导电性、反应热的比较、金属的腐蚀,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
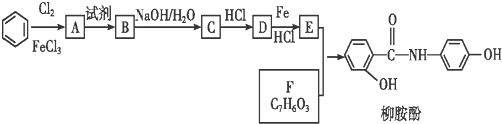
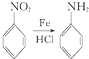
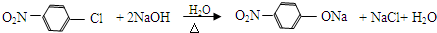
 .
.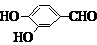 、
、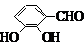 、
、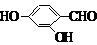 、
、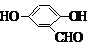 (其中三种)(写出3种).
(其中三种)(写出3种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 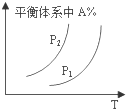 图中,若P1>P2,则该反应在较低温度下有利于自发进行 | |
| B. |  图中,若T2>T1,则△H<0且a+b=c+d | |
| C. | 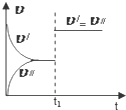 图中(v′表示正反应速率,v″表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 | |
| D. | 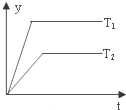 图中,若△H<0,则纵坐标不可能表示的是反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:
2014年12月6日中国经济网报道,日本东京大学科学家确定了两种新发现的具有高度活性的硅化物SiC2N和SiC3N分子,这项研究将有助于天文学家在星际介质中寻找相关分子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制取玻璃的工艺是应用了物质酸性的差异 | |
| B. | 家庭里可用淀粉检验加碘盐是否含有碘 | |
| C. | 铁是人体必需的微量元素,所以可以适当地吃点铁锈 | |
| D. | 王水是由浓盐酸和浓硝酸两种物质按3:1的体积比混合配制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
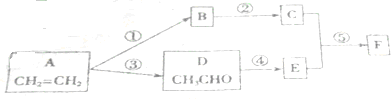

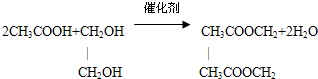 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com