
【题目】根据下列叙述,推测可能属于金属晶体的是( )
A.由分子间作用力结合而成,熔点很低
B.固体或熔融状态下易导电,熔点在1000℃左右
C.由共价键结合成空间网状结构,熔点很高
D.固体不导电,熔融状态下亦不导电,但溶于水后能导电
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究SO2的性质,按下图所示装置进行实验。
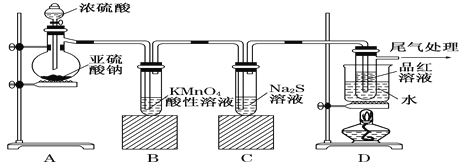
请回答下列问题:
(1)写出装置A中发生反应的化学方程式为_______________________;
(2)实验过程中,装置B、C中产生的现象分别是______________、__________,这些现象分别说明SO2具有的性质是________和________;装置B中发生反应的离子方程式为__________________________。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_______________________________________________。
(4)尾气可采用________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了火车客运安全,下列药品:①NH4NO3 ②(NH4)2SO4 ③食盐 ④油漆 ⑤汽油 ⑥黑火药 ⑦生石灰,从化学性质判断,由于易燃易爆而不能带上火车的是
A. ③④⑤⑥⑦ B. ①②⑦ C. ①④⑤⑥ D. ①④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题: 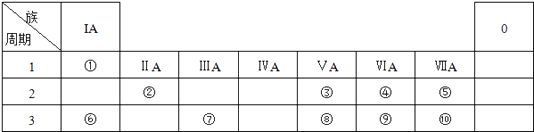
(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式
(2)用电子式表示⑥和⑨形成化合物的过程:
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为(用化学式表示).
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式 .
(5)⑤、⑥、⑩的离子半径由大到小的顺序为(用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 和SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法来减少这些有害气体的排放。
I.H2S 的除去
方法1: 生物脱H2S,反应的原理为H2S + Fe2(SO4)3==S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O。
2Fe2(SO4)3 +2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105 倍,该菌的作用是______。
(2)由图1和图2 判断,使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是______________。
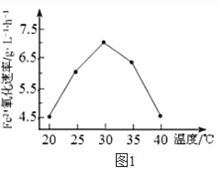
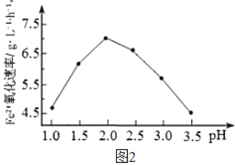
方法2: 在一定条件下,用H2O2 氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S) 变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物 的分子式为________。
II.SO2 的除去
方法1( 双碱法): 用NaOH 吸收SO2 ,并用CaO 使NaOH 再生:NaOH 溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:_________________。
(5)CaO 在水中存在如下转化:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
方法2:用氨水除去SO2
(6)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol/L,溶液中的c(OH-)=________。将SO2 通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c (SO32-)/c(HSO3-) =_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠大量用于染料和有机合成工业。用木屑制备亚硝酸钠的流程如下:
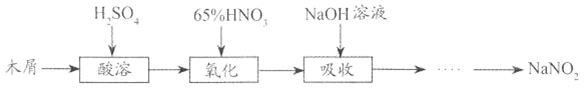
已知:①氧化过程中,控制反应液的温度在55~60℃,发生的主要反应为C6H12O6+12HNO3![]() 3H2C2O4+9NO2↑+3NO↑+9H2O;
3H2C2O4+9NO2↑+3NO↑+9H2O;
②NaNO2有氧化性,在酸性条件下能把I-氧化为I2;S2O32-能把I2还原为I-
③NaNO2也有还原性,能使酸性KMnO4溶液褪色
(1)酸溶过程中,发生的主要反应的化学方程式为______________。
(2)实验室模拟氧化和吸收过程的装置(加热和仪器固定裝置已略去)如下图所示
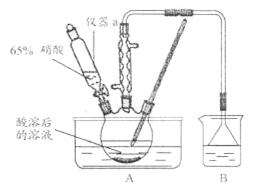
①实验装置图中仪器a的名称为______________。
②A装置须控制反应液的温度不高于60℃的原因是_____________。
③B装置用于制备亚硝酸钠,其中盛放的溶液是__________(填字母)。
a.NaCl溶液 b.Na2CO3溶液 c.NaNO3溶液
(3)工业上在吸收过程中需控制NO和NO2的物质的量比接近1:1。若n(NO):n(NO2)>l:1,则会导致________;若n(NO):n(NO2)<1:1,则会导致________。
(4)为测定产品NaNO2的纯度,请补充完整实验方案:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,________。(实验中可供选择的试剂:稀硫酸、淀粉溶液、酚酞试液、c1mol/LKI溶液、c2mol/LNa2S2O3溶液、c3mol/L酸性KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目: 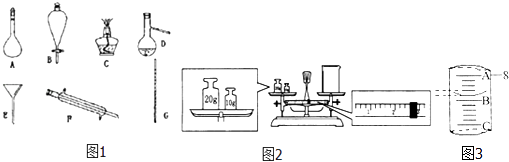
(1)现有图1所示各仪器:写出仪器名称D .
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图2.由图中可以看出,该同学在操作时的一个错误是 , 烧杯的实际质量为g.
(3)图3表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中液体的体积是mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硫酸氢钾复盐(化学式表示为K2SO4·KHSO4·2KHSO5),—般用作漂白剂及NOx、SO2等废气脱除剂。制备过硫酸氢钾复盐流程如图:
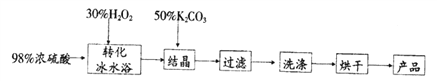
(1)在“转化”操作前,需先用冰水冷却双氧水,可能的原因是________________。“转化”过程中,浓硫酸与H2O2发生可逆反应生成过硫酸(H2SO5),写出该变化的化学反应方程式____________________。
(2)已知H2SO5为一元强酸。结晶操作中,加入K2CO3即可获得过硫酸氢钾复盐晶体,该过程的离子反应方程式为________________________;操作中,选用50%K2CO3溶液且需分批缓慢加入目的是____________。过硫酸氢钾复盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示。则该过程适宜的条件是________________。

(3)过滤后,用无水乙醇取代蒸馏水洗涤沉淀,目的是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com