
【题目】高倩同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )

A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂发生Cl2泄漏,以下应对措施中主要是基于Cl2的物理性质考虑的是
A. 向被污染的土壤洒石灰
B. 向远离污染源的高处撤离
C. 用浸有纯碱溶液的毛巾捂住口鼻迅速撤离
D. 来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微电子工业中 NF3 常用作氮化硅的蚀刻剂,工业上通过电解含 NH4F 等的无水熔融物生产NF3,其电解原理如图。下列说法不正确的是( )
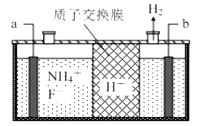
A. a 电极为电解池的阳极
B. 阳极的电极反应式: NH4++3F--6e—===NF3+4H+
C. 电解过程中可能还会生成少量氧化性极强的气体单质,该气体的分子式为 F2
D. H+由b极移向a极,并参与电极反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为几种晶体或晶胞的示意图:
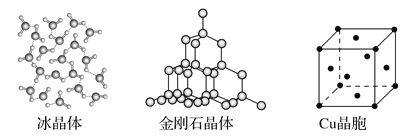
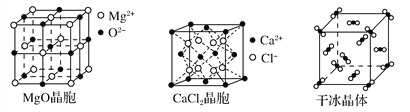
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能______(填“大于”或“小于”)MgO晶体,原因是________________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i. CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii. CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C—C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为__________________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0. 6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)______________ (填“>”“<”或“=”)V逆(HCl).
(4)一定压强下,向密闭容器中充入一定量的CH2=CHCH3和C12发生反应ii。设起始的![]() =w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
=w,平衡时Cl2的体积分数(φ)与温度(T)、w的关系如图甲所示。W=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
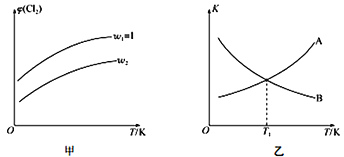
①图甲中,w2__________(填“>”“<”或“=”)1
②图乙中,表示正反应平衡常数的曲线为____________(填“A”或“B”),理由为________________。
③T1K下,平衡时a(Cl2)= ________________。
(5)起始时向某恒容绝热容器中充入1 mol CH2 =CHCH3和1 mol Cl2发生反应ii,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由白磷(P4:易自燃,熔点44℃,沸点280℃,有剧毒,保存在冷水中)制备六偏磷酸钠的方法如下:
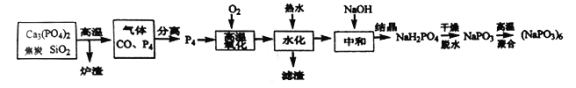
(1)“炉渣”的主要成分是___________(写化学式),该过程中氧化剂与还原剂的物质的量之比是_______________。
(2)从混合气体中分离得到P4的最佳方法是_________________。
(3)经分析“滤渣”是由白磷中的Pb、As杂质元素所形成的两种盐类,其中一种是Pb3(PO4)2,则另一种是_______________ (写化学式)。
(4)若直接将白磷与足量浓NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体。写出该化学方程式____________________。
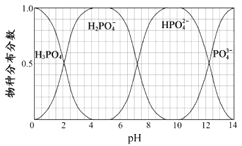
(5)已知磷酸中含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示,则“中和”过程中应加入NaOH调节溶液的pH值为________________。若pH过低,则造成的结果是_________________。
(6)经定量分析,毎100.00g产品的有效磷(以P2O5计)含量是66.50g (其它杂质为非磷酸盐成分),则该产品的纯度是__________________。(已知:NaPO3的相对分子质量为M1,P2O5的相对分子质量为M2,结果不必化简,列出计算式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com