
| 1 |
| 1 |
| 6 |
| 12 |
| 16 |
| 16 |
 ,
, ;
;| 1 |
| 1 |
| 6 |
| 12 |
| 16 |
| 16 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
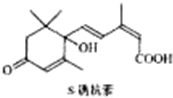 对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开.S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为( )
对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开.S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为( )| A、1mol | B、2mol |
| C、3mol | D、4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后的溶液呈酸性 |
| B、两种反应物中水电离出的c(H+)都是1×10-12mol?L-1 |
| C、反应后的溶液中:c(CH3COO-)+c(CH3COOH)═0.01mol?L-1 |
| D、反应后的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
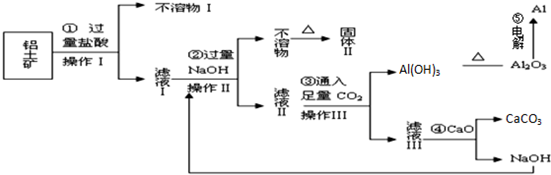
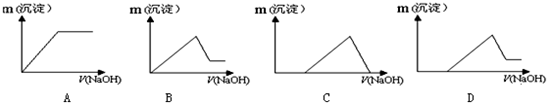
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2- | NaCl | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
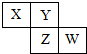
| A、Z元素的原子半径比Y元素的大 |
| B、若Y的最低化合价为-2,则W的最高正化合价为+6 |
| C、若Z的最高正化合价为+5,则X元素的化合物最多 |
| D、若HmZOn为强酸,则Y是活泼非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com