
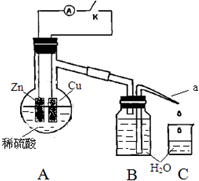
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析 (1)Zn与稀硫酸反应生成硫酸锌和氢气;
(2)浓硫酸具有强氧化性,与Zn反应生成二氧化硫;
(3)①Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
②ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
根据盖斯定律:①+②-③得Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2↑,据此计算;
(3)①形成原电池能加快反应速率;
②根据氢离子浓度大小与速率的关系分析;
③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,根据温度对速率的影响分析.
解答 解:(1)Zn与稀硫酸反应生成硫酸锌和氢气,其反应的离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(2)浓硫酸具有强氧化性,与Zn反应生成二氧化硫,所以制H2时,用稀硫酸而不用浓硫酸,故答案为:浓H2SO4具有强氧化性,不能生成氢气;
(3)①Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
②ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
根据盖斯定律:①+②-③得Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2↑,则△H=(-332kJ/mol)+(-112kJ/mol)-(-286kJ/mol)=-158kJ/mol;
故答案为:-158;
(3)①形成原电池能加快反应速率,所以在反应初期,闭合K时比断开K时的反应速率快,故答案为:快;形成原电池反应速度快;
②由于反应前期形成原电池反应速率快,氢离子消耗的多,则在后期,闭合K时溶液中氢离子浓度小,氢离子浓度越小反应速率越小,断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),所以在反应后期,断开K时的反应速率快于闭合K时的反应速率;
故答案为:断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+);
③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,则随着反应进行,断开K时,放出的热量使溶液的温度升高,温度越高反应速率越快;
故答案为:断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
点评 本题考查了盖斯定律的应用、原电池原理的应用、影响速率的因素等,题目难度中等,注意形成原电池能加快反应速率.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铪-185的原子核内有72个电子 | B. | 其中子数比电子数多41 | ||
| C. | 是铪-180的一种新的同素异形体 | D. | 铪-185的原子核内有185个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的限度都相同 | |
| B. | 化学反应的限度可以改变 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到限度时,反应即停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; 的系统命名为2,5-二甲基-3-乙基庚烷.
的系统命名为2,5-二甲基-3-乙基庚烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;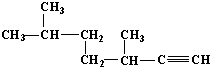 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;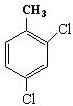 ;
; ,分子式为C15H22O2;
,分子式为C15H22O2;  中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C和Mg | B. | Si和Na | C. | Cl和C | D. | B和He |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | ||||
| R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com