
【题目】下列关于硅和二氧化硅的说法中不正确的是
A. 硅和二氧化硅都是熔沸点很高、硬度很大的物质
B. 硅和二氧化硅都能与强碱(如氢氧化钠)溶液反应
C. 硅和二氧化硅都能与硫酸、硝酸反应
D. 硅晶体和二氧化硅都由原子构成
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】有机物命名中常使用三套数字,甲、乙、丙…,1、2、3…,一、二、三…。其中“一、二、三…”指的是( )
A.碳原子数B.氢原子数C.碳链位置编号D.某种基团的数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B. 没有单质参加的反应一定不是氧化还原反应
C. 置换反应一定是氧化还原反应
D. 失电子难的原子,容易获得电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A |
| Fe2+、NO3-、Al3+、Cl- | 不能大量共存, 3Fe2++4H++NO3-=3Fe3++NO+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、AlO2- | 能大量共存 |
C | 含有大量Al3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存, 2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是___________________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。

其中,离子交换膜使用的是__________(阳离子交换膜、阴离子交换膜),阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:________。
(2)装置B中饱和食盐水的作用是______;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是_________(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是______,该现象____(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是________。
(5)装置F的烧杯中的溶液不能选用下列中的_________(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.0mol/L的浓硫酸稀释成1.8mol/L的稀硫酸100ml,实验操作如下:
(1)A. 将配好的稀硫酸倒入试剂瓶中,贴好标签;
B. 盖好容量瓶塞,反复颠倒,摇匀;
C. 用量筒取mL的18.0mol/L的浓硫酸;
D. 将沿烧杯内壁慢慢注入盛有少量的烧杯中;
E. 用少量蒸馏水洗涤烧杯2﹣3次,并将洗涤液也全部转移到容量瓶中;
F. 将已冷却至室温的硫酸溶液沿玻璃棒注入100mL的容量瓶中;
G. 改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H. 继续向容量瓶加蒸馏水,直到液面接近刻度线cm处.
填写上述步骤中的空白;
(2)请按正确的操作步骤进行排序 .
(3)试分析下列操作会使所配溶液的浓度会大于1.80mol/L浓度
A.用量筒取浓硫酸时,为了精确,用水洗涤量筒,并将洗涤液倒入烧杯中.
B.溶解后,立刻移液.
C.若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线.
D.若定容时仰视看刻度线,会使稀硫酸溶液的浓度.
E.若摇匀后发现液面低于刻度线,又加水至刻度线.
(4)取20ml配好的硫酸,和足量的铝反应后,可收集到标准状况下的H2ml.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
烧,并产生大量白烟.以下叙述错误的是( )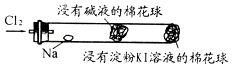
A.钠着火燃烧产生苍白色火焰和白烟
B.白烟是氯化钠微晶分散在空气中形成
C.玻管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境
D.根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com