
| ʵ����� | �¶ȡ� | ѹǿ/kPa | CH4��ʼŨ��/mol•L-1 | H2O��ʼŨ��/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
���� ��1�����ݸ�˹���ɵâ�+��+$\frac{1}{2}$���ۼ��������һ���ϳ�Һ̬�״����Ȼ�ѧ����ʽ��
��2���ٷ�Ӧ�����ȷ�Ӧ���¶����ߣ�������У�k���ڸ��ݻ�ѧƽ�ⳣ��k��������ʽ��ʾƽ��ʱ��Ũ�ȣ�����ת���ʣ�
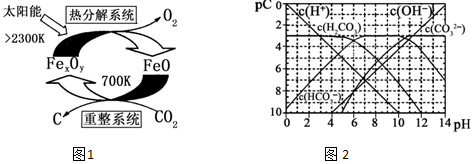
��3������ʾ��ͼ��֪������ϵͳ��CO2��FeO��Ӧ����FexOy��C������ԭ���غ�ȷ��FexOy�Ļ�ѧʽ��
���ȷֽ�ϵͳ����FexOy�ֽ�ΪFeO������������FeԪ�ػ��ϼ۱�ۼ���ת�Ƶ��ӣ�
��4���ٸ������Ӵ�����Һ��������жϣ�
����ͼ���֪��pH=6ʱ��pC��H2CO3��=pC��HCO3-�������Ka1��H2CO3��=$\frac{c��{H}^{+}��•c��HC{{O}_{3}}^{-}��}{c��{H}_{2}C{O}_{3}��}$���㣻
�ۡ�������Һ���м���������ǿ���ǿ���Һ��pH�仯���������ʱ��̼��������ӷ�Ӧ��
��� �⣺��1�����Ȼ�ѧ����ʽ��
��CH4��g��+H2O��g��?CO��g��+3H2��g����H1=+206.1kJ•mol-1
��2H2��g��+CO��g��?CH3OH��l����H2=-128.3kJ•mol-1
��2H2��g��+O2��g��?2H2O ��g����H3=-483.6kJ•mol-1
���ݸ�˹���ɣ���+��+$\frac{1}{2}$���۵�CH4��g��+$\frac{1}{2}$O2 ��g��?CH3OH��l����H1=-164.0kJ•mol-1��
�ʴ�Ϊ��CH4��g��+$\frac{1}{2}$O2 ��g��?CH3OH��l����H1=-164.0kJ•mol-1
��2���ٷ�Ӧһ�����ȷ�Ӧ���¶����ߣ���ѧƽ�������ƶ���kֵ���ʵ��2���¶ȸ���ʵ��3������k2��k3
�ʴ�Ϊ����
����CH4��H2O����ʼ��Ϊx����������ʽ��
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ����x x 0 0
ת������0.1 0.1 0.1 0.3
ƽ������x-0.1 x-0.1 0.1 0.3
��ƽ�ⳣ������ʽk=$\frac{c��CO��•c^3����{H}_{2}��}{c��C{H}_{4}��•c��{H}_{2}O��}$=$\frac{0.1mol/L•��0.3mol/L��^3}{��x-0.1��mol/L•��x-0.1��mol/L}$=27�����x=0.11����ƽ��ʱ�����ת����Ϊ��$\frac{0.1mol}{0.11mol}��100%$=90.9%��
�ʴ�Ϊ��$\frac{10}{11}$��90.9%��90.91%��$\frac{10}{11}$��100%��
��3��������ʾ��ͼ��֪������ϵͳ��CO2��FeO��Ӧ����FexOy��C�������ķ�Ӧ��n��FeO����n��CO2��=6��1������Feԭ�ӡ�Oԭ���غ��֪x��y=6����6+2��=3��4����FexOy�Ļ�ѧʽΪFe3O4��
�ʴ�Ϊ��Fe 3O4
���ȷֽ�ϵͳ����Fe3O4�ֽ�ΪFeO���������ֽ�l mol Fe3O4ת�Ƶ��ӵ����ʵ���Ϊ$1mol��3����\frac{8}{3}-2��$=2mol��
�ʴ�Ϊ��2mol
��4����̼����ڵ���Һ�����Խ�ǿ��̼������Ӵ��ڵ���Һ�м��Խ�ǿ������̼������Ӻ�̼��ܴ������森
�ʴ�Ϊ�����ܣ�
����ͼ���֪��pH=6ʱ��pC��H2CO3��=pC��HCO3-�������Ka1��H2CO3��=$\frac{c��{H}^{+}��•c��HC{{O}_{3}}^{-}��}{c��{H}_{2}C{O}_{3}��}$=$\frac{1{0}^{-6}•c��HC{{O}_{3}}^{-��}}{c��{H}_{2}C{O}_{3}��}$=1��10-6��
�ʴ�Ϊ��1��10-6
��������Ũ������ƽ�������ƶ��ų�CO2��̼��Ũ�Ȼ������䣬��c��H+��/c��H2CO3�����ս����
�ʴ�Ϊ��A
���� ���⿼���˸�˹���ɵ�Ӧ�ã����������ˮ��Һ�еĵ���ƽ�⣬���ʵ�������ؼ��㣬��ѧƽ��ļ��㼰Ӱ�����أ��ۺϿ��飬�ѶȽϴ�


 ͬ������ϵ�д�
ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼ��ʾ��һ�������½�lmolA�����3molB�������һ������ɱ���ܱ������У��ɻ���������λ��ͼ1��ʾ���ں��º�ѹ�·���A��g��+3B��g��?2C��g��������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ����ƽ��ʱA��ת����Ϊ��������
��ͼ��ʾ��һ�������½�lmolA�����3molB�������һ������ɱ���ܱ������У��ɻ���������λ��ͼ1��ʾ���ں��º�ѹ�·���A��g��+3B��g��?2C��g��������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ����ƽ��ʱA��ת����Ϊ��������| A�� | 20% | B�� | 40% | C�� | 50% | D�� | ��ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2���SO2������O2��Ӧ��һ����������2���SO3 | |
| B�� | �����������䣬����ѹǿ������Ӧ���������淴Ӧ����Ҳ���� | |
| C�� | ����2molSO2��1molO2�ų��������Ǽ���1molSO2��0.5molO2�ų�������2�� | |
| D�� | ƽ����ټ���1molSO3��SO2��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ᡢ���ʯ�� | B�� | ���ᡢ�ռС�մ� | ||
| C�� | ̼�ᡢ�Ҵ��������� | D�� | ���ᡢ��ʯ�ҡ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ���У�pN=7 | |
| B�� | ������Һ���У�c��NH4+��•c��NH2-����1.0��10-14 | |
| C�� | 1 L�ܽ���0.001 mol NH4C1��Һ����Һ����pN=3 | |
| D�� | 1 L�ܽ���0.001 mol NaNH2��Һ����Һ����pN=11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2��Fe3+��I2��S | B�� | Cl2��I2��Fe3+��S | C�� | Cl2��Fe3+��S��I2 | D�� | Fe3+��I2��C12��S |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com