
| A. | 放电时,H2SO4浓度增加 | |
| B. | 放电时,负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸 | |
| D. | 在充电时,阴极发生的反应是PbSO4-2e-+2H2O═PbO2+SO42-+4H+ |
分析 A.根据电池反应式确定硫酸浓度是否变化;
B.原电池负极上失电子发生氧化反应;
C.根据充电的总反应分析,每生成1molPb,则转移2mol电子,同时也生成2mol硫酸,据此分析;
D.充电时,负极与阴极相连得电子发生还原反应.
解答 解:A.根据电池反应式知,放电时消耗硫酸,所以硫酸浓度降低,故A错误;
B.蓄电池放电时,负极上铅失电子和硫酸根离子反应生成硫酸铅,电极反应式为:Pb+SO42--2e-=PbSO4,故B正确;
C.由充电的总反应分析,每生成1molPb,则转移2mol电子,同时也生成2mol硫酸,所以电池中每转移1mol电子,理论上生成1mol硫酸,故C错误;
D.充电时,负极与阴极相连,则阴极的电极反应为PbSO4+2e-=Pb+SO42-,故D错误;
故选B.
点评 本题考查铅蓄电池,注意原电池和电解池的分析,明确工作原理及电子守恒是解答本题的关键,题目难度中等.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
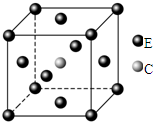 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.| 实验步骤 | 实验现象 | 结论与化学反应方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | 物质WY2、W3X4、WZ4均有熔点高、硬度小的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
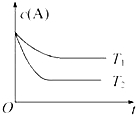 反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol•L-1.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题:
反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol•L-1.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com