
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

完成下列填空(填元素符号或化学式):
(1)元素B在元素周期表中的位置是第____周期第_____族,A、B、C三种元素原子半径从大到小的顺序是_________________;
(2)D简单离子的结构示意图为_____________,D、E中金属性较强的元素是________。D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。
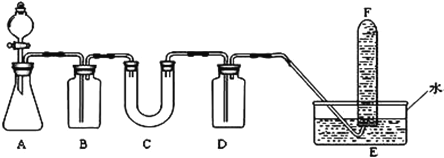
(3)装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去_____________;
(4)装置C中X与CO2反应的化学方程式是_____________________,装置D盛放NaOH溶液的作用是除去____________;
(5)为检验试管F收集的气体,进行____________操作,出现_________现象,即证明X可作供氧剂。
【答案】二 VA N>O>H ![]() Na HCl 2Na2O2+2CO2=2Na2CO3+O2 CO2 将带火星的木条靠近气体 木条复燃
Na HCl 2Na2O2+2CO2=2Na2CO3+O2 CO2 将带火星的木条靠近气体 木条复燃
【解析】
根据题给的部分元素周期表,明确A、B、C、D、E分别为H、N、O、Na、Mg等元素。用好元素周期律进行原子半径、金属性强弱的判断即可。
(1)根据题给图示,元素B在元素周期表的第二行,从左数第5种元素,所以其在元素周期表的位置表达为第2周期第VA族;元素A、B、C分别为H、N、O,它们的原子半径的从大到小顺序为:N>O>H;
(2)元素D为钠元素,其简单离子的电子式表达为:![]() ,注意看清是离子;元素E为Mg元素,金属性Na>Mg;钠在氧气中燃烧生成的淡黄色粉末为Na2O2;
,注意看清是离子;元素E为Mg元素,金属性Na>Mg;钠在氧气中燃烧生成的淡黄色粉末为Na2O2;
(3)浓盐酸具有强的挥发性,所以制得的CO2气体中混有大量的氯化氢气体,装置B中饱和NaHCO3溶液的作用是除去挥发出的HCl:NaHCO3+HCl=NaCl+H2O+CO2↑,既除去了HCl,又生成了主要成分CO2,又降低了CO2气体在溶液中的溶解损耗;
(4)Na2O2与CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2;装置D盛放NaOH溶液的作用是除去O2中未反应的CO2;
(5)为检验试管F收集的气体是氧气,可用带火星的木条进行检验,如果木条复燃,说明收集到的是O2,从而说明过氧化钠能与二氧化碳反应生成O2,可用作供氧剂。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
A(g)+B(g)![]() 2C(g) ΔH1<0;
2C(g) ΔH1<0;
X(g)+3Y(g)![]() 2Z(g) ΔH2>0。
2Z(g) ΔH2>0。
进行相关操作且达到化学平衡后(忽略体积改变所做的功),下列叙述错误的是
A. 等压时,通入惰性气体,C的物质的量不变
B. 等压时,通入Z气体,反应器中温度升高
C. 等容时,通入惰性气体,各反应速率不变
D. 等容时,通入Z气体,Y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液与硫酸的反应: OH+H+=H2O
B.铜片插入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag
C.碳酸钙溶于稀盐酸中: CaCO3+2H+=Ca2++H2O+CO2
D.铁与稀硫酸反应:2Fe +6H+ = 2Fe2+ + 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出制备氢氧化铁胶体的化学方程式:___;
(2)写出盐酸除铁锈(主要成分Fe2O3)的离子方程式:___;
(3)写出NaHSO4溶液与Ba(OH)2溶液混合呈中性的离子方程式:___;
(4)写出NaHCO3溶液与少量澄清石灰水反应的离子方程式:___;
(5)写出硫酸铜溶液与氢氧化钡溶液反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A.16g由O2和O3组成的混合气体中的氧原子数为2NA
B.1molN2与足量H2充分反应生成NH3的分子数为2NA
C.1mol Fe溶于过量稀硝酸,转移的电子数为3NA
D.标准状况下,2.24L苯中含有的原子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
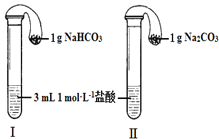
①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) ![]() 2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将 1 mol 的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
A. △H2>△H3
B. △H1<△H3
C. △H1+△H3=△H2
D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为__L,它与标准状况下__L硫化氢含有相同数目的氢原子。
(2)同温同压下,SO2与氦气的密度之比为___;若质量相同,则两种气体的体积之比为___;若体积相同,两种气体的质量之比为___。
(3)在标准状况下,①4gH2;②11.2LO2;③1molH2O中,所含分子数最多的是(填序号,下同)___,含原子数最多的是___,质量最大的是___,体积最小的是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com