
测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与 I-反应生成 I3-,并在溶液中建立如下平衡: I2+I- I3-。通过测平衡体系中 c(I2)、 c(I-)和 c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中 c(I2)、 c(I-)和 c(I3-),就可求得该反应的平衡常数。
Ⅰ.某同学为测定上述平衡体系中 c(I2),采用如下方法:取 V1 mL 平衡混合溶液,用cmol·L-1的Na2S2O3溶液进行滴定(反应为 I2+2Na2S2O3=2NaI+Na2S4O6),消耗 V2 mL 的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用________做指示剂,滴定终点的现象是_____________________。
(2)下列对该同学设计方案的分析,正确的是________(填字母)。
A.方案可行。能准确测定溶液中的 c(I2)
B.不可行。因为 I-能与 Na2S2O3发生反应
C.不可行。只能测得溶液中 c(I2)与 c(I3-)之和
Ⅱ.化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):

已知: ①I-和 I3-不溶于 CCl4; ②一定温度下, 碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即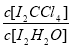 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是________(填名称)。试指出该操作中应注意的事项为________。 (任写一条)
(4)上述测定过程均正常操作,下层液体中碘单质的物质的量浓度是________;若终点读数时俯视滴定管, 则会造成所测浓度________ (填“等于”、 “大于”或“小于”)该值。
(5)实验测得上层溶液中 c(I3-)=0.0049 mol·L-1,结合上述有关数据,计算室温条件下反应 I2+I- I3-的平衡常数 K=________(用具体数据列出计算式即可)。
I3-的平衡常数 K=________(用具体数据列出计算式即可)。
科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:选择题
恒温恒容下,反应A(g)+B(g)=2C(g)的平衡常数为4,现向该容器中投入lmol的C物质, 平衡时,C的转化率为()
A.20% B.33% C.50% D.89%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)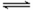 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol﹒L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为____________,属于___________分子(填“极性”或“非极性”),E的基态原子的外围电子排布式为____________。
(2)B、C、D三种元素 的第一电离能由小到大的顺序为____________。
的第一电离能由小到大的顺序为____________。
(3)C元素形成含氧酸酸性强弱:HNO3____________H NO2(填“>”或“<”)NO3—的空间构型是___________,NO2—中心原子的杂化方式为___________
NO2(填“>”或“<”)NO3—的空间构型是___________,NO2—中心原子的杂化方式为___________
(4)下列叙述正确的是____________(填序号)。
A. M是极性分子,N是非极性分子
B. M和BD2分子中的中心原子均采用sp2杂化
C. N分子中含有6个σ键和1个大π键
D. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示:
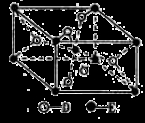
①Q(s)+2Cl2(g)=ECl4(l)+D2(g) △H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4和BD气体的热化学方程式:____________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
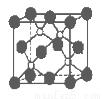
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:选择题
室温下,将一元酸 HA 的溶液和 KOH 溶液等体积混合(忽略体积变化),实验数据如下表:
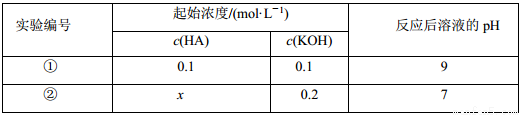
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=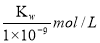
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:填空题
化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-=FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只有在强碱性条件下稳定,易被H2还原。
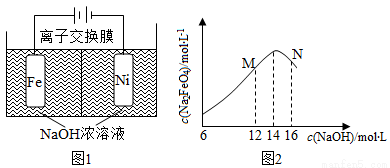
①电解一段时间后,c(OH-)降低的区域在__________(城 “阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第四次月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.泡沫灭火器的灭火原理是硫酸铝与苏打溶液发生反应
B.食用油反复加热会产生稠环芳烃等有害物质
C.用FeCl3腐蚀印刷电路板是因为铁的金属性强于铜
D.工业酒精浓度高于医用酒精,所以其消毒能力更强
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练三化学试卷(解析版) 题型:选择题
在温度相同时,100mL0.01mol/L的CH3OOH溶液与10mL0.1mol/LCH3COOH溶液相比较,下列叙述中前者大于后者的是( )
A.CH3OOH的物质的量
B.溶液中的n(H+)
C.用同浓度的NaOH溶液恰好完全反砬,消耗NaOH溶液的体积
D.溶液的导电能力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com