
| A. | 煤的液化制备燃料 | B. | 分馏石油制汽油 | ||
| C. | 可以用热的纯碱溶液除去油污 | D. | 医用酒精用于皮肤的消毒 |
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:解答题
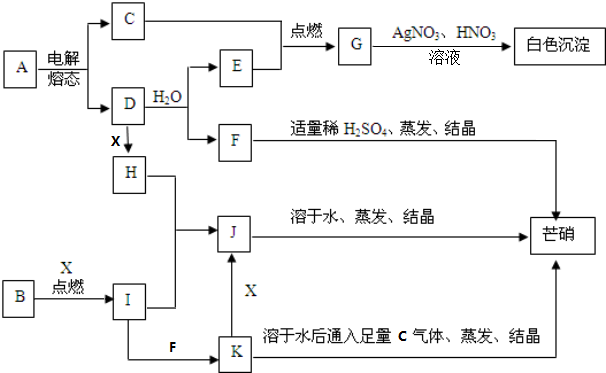
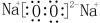 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人的皮肤在强紫外线的照射下不会失去生理活性 | |
| B. | 常用新制的氢氧化铜检验司机酒后驾车 | |
| C. | 棉花和木材的主要成分都是纤维素 | |
| D. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹食醋缓解不适 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
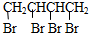
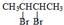 +2NaOH$→_{△}^{乙醇}$CH2=CHCH=CH2↑+2NaBr+2H2O
+2NaOH$→_{△}^{乙醇}$CH2=CHCH=CH2↑+2NaBr+2H2O| A | B | C | |
| 加入氯化铁溶液 | 显紫色 | 无明显现象 | 无明显现象 |
| 加入钠 | 放出氢气 | 放出氢气 | 不反应 |
| 苯环上一氯代物的种数 | 2 | 3 | 3 |
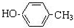 B
B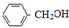 C
C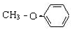
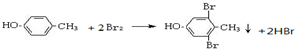
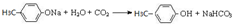
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,0.1mol•L-1的醋酸溶液PH=3,则其电离常数Ka≈1.0×10-4 | |
| B. | Ka、Kb、Kh均随温度升高而增大 | |
| C. | 弱酸HA的电离平衡常数为Ka,则A-的水解平衡常数为Kh=Ka•Kw | |
| D. | 因为Ksp(AgCl)<Ksp(AgOH),所以AgCl不溶于稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 6 | C. | 8 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫 | B. | 二氧化硅 | C. | 铁 | D. | 氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com