
分析 加入碱前,体系是含Mg2+、Na+、NH4+、Cl-的电解质溶液,依电荷守恒得:2n(Mg2+)+n(Na+)+n(NH4+)=n(Cl-).
根据氮元素守恒有n(NH4+)=n(NH3),根据氯原子守恒有n(Cl-)=n(HCl),根据钠原子守恒有n(Na+)=n(NaOH),计算出n(NH4+)、n(Cl-)、n(Na+),代入电荷守恒等式计算出n(Mg2+),根据镁元素守恒可知n(Mg)=n(Mg2+),再利用m=nM计算镁条质量.
解答 解:加入热碱前,体系是含Mg2+、Na+、NH4+、Cl-的电解质溶液,溶液中:
n(Cl-)=n(HCl)=1.8 mol•L-1×0.05L=0.09mol,
n(Na+)=n(NaOH)=0.9 mol•L-1×0.02L=0.018mol,
n(NH4+)=n(NH3)=$\frac{0.102g}{17g/mol}$=0.006 mol,
依电荷守恒得:2n(Mg2+)+n(Na+)+n(NH4+)=n(Cl-),所以2n(Mg2+)+0.018mol+0.006mol=0.09,
解得n(Mg2+)=0.033mol,所以n(Mg)=n(Mg2+)=0.033mol,故镁条的质量 m(Mg)=0.033mol×24g/mol=0.792g,
答:原镁条的质量为0.792g.
点评 本题考查混合物、根据方程式的计算等,难度较大,清楚反应过程,利用电荷守恒进行解答是关键,注意守恒思想在计算中的运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
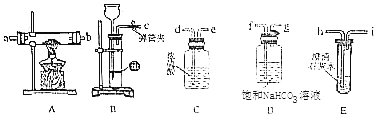
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
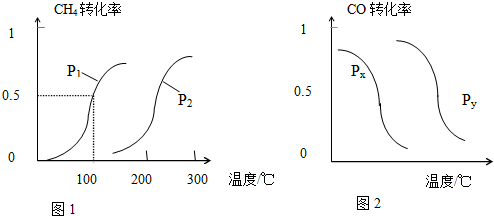
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 糖类 | 油脂 | 蛋白质 | 其他 | |
| 花生米 | 24% | 39% | 26% | 11% |
| 小麦 | 76% | 2% | 11% | 11% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压下,相同体积的任何气体单质所含的分子数目一定相同 | |
| B. | 1L 0.5mol/L FeCl3溶液完全转化可得0.5NA个Fe(OH)3胶粒 | |
| C. | 标准状况下,22.4L苯含有的分子数为1NA | |
| D. | 在常温常压下,11.2 L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com