
| A. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 | |
| B. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 |
分析 A.乙烷、乙烯都可与氯气在光照条件下发生取代反应;
B.乙酸与生石灰反应,则增大混合物沸点差;
C.二者都与碳酸钠反应;
D.二者都与氢氧化钠反应.
解答 解:A.乙烷、乙烯都可与氯气在光照条件下发生取代反应,应用溴水除杂,乙烯与溴水发生加成反应,故A错误;
B.乙酸与生石灰反应,则增大混合物沸点差,可蒸馏分离,故B正确;
C.二者都与碳酸钠反应,应用碳酸氢钠溶液除杂,故C错误;
D.二者都与氢氧化钠反应,应用饱和碳酸钠溶液除杂,故D错误.
故选B.
点评 本题考查物质分离、提纯方法的选择,为高频考点,把握物质的性质及常见混合物分离方法、分离原理为解答的关键,注重基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
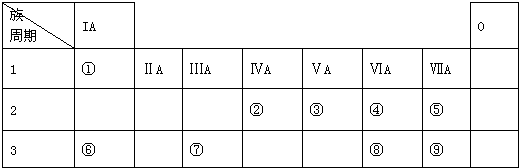
| A. | 除⑥外 | B. | 除⑥、⑦外 | C. | 除⑥、⑦、⑧外 | D. | 除①、②、③、④、⑤外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.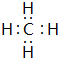
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:K+、SO42-、Cu2+、Cl- | |
| B. | 0.1mol/L 的FeCl2的溶液中:H+、Na+、NO3-、Cl- | |
| C. | 使甲基橙变红的溶液中:K+、HCO3-、Ba2+、I- | |
| D. | c(H+)/c(OH-)=1×10-12:NH4+、Cl-、Ca2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
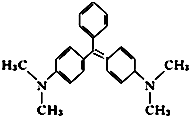 孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸. 其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )
孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸. 其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )| A. | 孔雀石绿的分子式为C23H25N2 | |
| B. | 孔雀石绿属于芳香烃 | |
| C. | 孔雀石绿苯环上的一氯取代物有5种 | |
| D. | 1mol孔雀石绿在一定条件下最多可与6 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共有4种,其中一种物质不属于羧酸 | |
| B. | 共有5种,其中一种为二元酸 | |
| C. | 共有6种,其中只有一种不是有机酸 | |
| D. | 共有6种,它们在一定条件下均能与乙醇发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
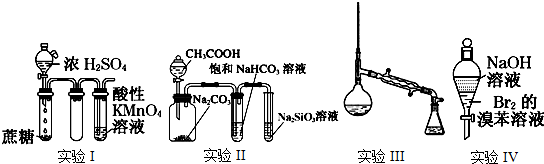
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
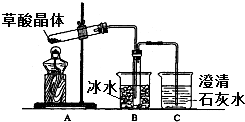 草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:
草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
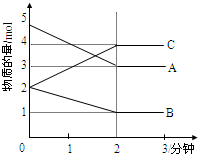 Ⅰ对于4FeS2+11O2═2Fe2O3+8SO2,试回答有关的问题:
Ⅰ对于4FeS2+11O2═2Fe2O3+8SO2,试回答有关的问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com