
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
(1)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
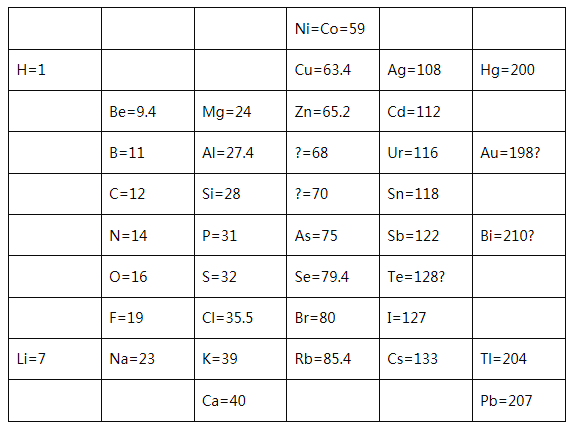
①门捷列夫将已有元素按照相对原子质量排序,同一_________(填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是______,第5列方框中“Te=128?”的问号表达的含义是________。
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是_____(填字母序号)。
A. 随着核电荷数递增,元素主要化合价呈现周期性变化
B. 随着核电荷数递增,原子核外电子排布呈现周期性变化
C. 随着核电荷数递增,原子半径呈现周期性变化
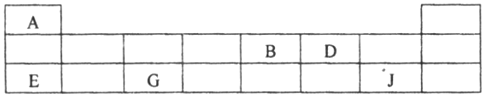
(2)短周期元素A、B、D、E、G、J在周期表中的位置如下:
根据上表回答问题:
①第三周期的四种元素中离子半径最小的是_________ (用元素符号填答)。
②B、D的非金属性由大到小的顺序是__________ (用元素符号填答)。
③E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为i.H++OH-=H2O、ii.___、iii.___。
④用电子式表示A2D形成过程_______________。
(3)元素Y的一种含氧酸化学式为 H3YO3,其结构式可表示为:![]() 。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式_____。(用对应元素符号填答)(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式_____。(用对应元素符号填答)(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
【答案】横行 预测此处应有一个相对原子质量为70的元素 怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间) B Al3+ O>N Al(OH)3+OH-=AlO2-+2H2O Al(OH)3+3H+=Al3++3H2O ![]() 二 H3PO3+2NaOH=Na2HPO3+2H2O
二 H3PO3+2NaOH=Na2HPO3+2H2O
【解析】
(1)①根据上表可知,门捷列夫将已有元素按照相对原子质量排序,同一横行的元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表示预测此处应有一个相对原子质量为70的元素;第5列方框中“Te=128?”的问号表示怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间),故答案为:横行;预测此处应有一个相对原子质量为70的元素;怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间)。
②元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化,其本质原因是随着核电荷数递增,原子核外电子排布呈现周期性变化,故B正确,故答案为:B。
(2)由短周期元素A、B、D、E、G、J在周期表中的位置可以知道A、B、D、E、G、J分别为H、N、O、Na、Al、Cl。
①第三周期的三种元素形成的三种离子分别为Na+、Al3+、Cl-,电子层数越多,半径越大,具有相同电子层结构的离子,核电荷数越大,半径越小,所以这三种离子中离子半径最小的是Al3+,故答案为:Al3+。
②B、D为同一周期的元素,同一周期的元素,从左向右,非金属性逐渐增强,非金属性由大到小的顺序是O>N,故答案为:O>N。
③E、G、J的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,Al(OH)3为两性氢氧化物,既能与酸反应又能与强碱反应,两两之间反应的离子方程式分别为H++OH-=H2O、Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O。
④A2D为H2O,用电子式表示其形成过程为:![]() ,故答案为:
,故答案为:![]() 。
。
(3)从结构式![]() 可知,该分子中含有2个羟基,故该酸为二元酸,该酸与过量的氢氧化钠反应的化学方程式为:H3PO3+2NaOH=Na2HPO3+2H2O,
可知,该分子中含有2个羟基,故该酸为二元酸,该酸与过量的氢氧化钠反应的化学方程式为:H3PO3+2NaOH=Na2HPO3+2H2O,
故答案为:二、H3PO3+2NaOH=Na2HPO3+2H2O。


科目:高中化学 来源: 题型:
【题目】在一支25mL的酸式滴定管中盛入0.1mol/L的HCl溶液,其液面恰好在5mL刻度处,若把滴定管中的溶液全部放入烧杯中,则HCl溶液的体积是
A.大于20mLB.小于20mLC.等于20mLD.等于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2反应生成C2A与气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:B_______,E_____。
(2)写出电子式:EB4__________。
(3)D2A2中含有的化学键为___________。
(4)由A、C、D三种元素组成的化合物M属于______(填“离子”或“共价”)化合物,M溶于水后_____(填“会”或“不会”)发生化学变化,原因是_______(从化学键的角度解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是

A. 氧气在石墨电极上发生氧化反应
B. 该电池的负极反应为Zn+H2O-2e- = ZnO+2H+
C. 该电池充电时应将Zn电极与电源负极相连
D. 该电池放电时OH-向石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验操作可能会导致实验结果偏高的是( )
A. 配制一定物质的量浓度的溶液:移液后未洗涤烧杯
B. 配制一定物质的量浓度的溶液:定容时仰视刻度线
C. 配制一定物质的量浓度稀硫酸时:用量筒量取浓硫酸时俯视读数
D. 用浓硫酸与烧碱的稀溶液反应来测定中和热的数值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为一2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g、FeCl20.425 mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A. 100 mL的盐酸中HC1物质的量浓度为8.5 mol/L
B. 生成的H2S气体在标准状况下的体积为5.6L
C. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3 : 1
D. 该磁黄铁矿中FexS的x=0.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的描述正确的是( )
A. 有7个周期,18个族
B. 第IA族元素也称为碱金属元素
C. 元素种类最多的族为第IIIB族
D. 元素周期表中每个周期均从金属元素开始,以非金属元素结束
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10—16 | 4.0×10—38 | 6.0×10—31 | 6.5×10—18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO46H2O晶体;
④用少量乙醇洗涤NiSO46H2O晶体并晾干。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com