
硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同族,与 K 同周期,关于硒的说法中不正确的是
A.原子序数为 34
B.最高价氧化物的水化物的分子式为:H2SeO4
C.Se的非金属性比 Br 弱
D.气态氢化物的稳定性比硫化氢气体强
科目:高中化学 来源:2014-2015湖南省益阳市高二3月月考化学试卷(解析版) 题型:?????
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O42NO2 △H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是

A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省台州市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组物质中,属于同分异构体且属于碳链异构的是:
A.CH3CH2CH2CH3和CH3CH(CH3)2
B.CH2=C(CH3)2和CH3CH=CHCH3
C.CH3COOH和HCOOCH3
D.CH3CH2CHO和CH3COCH3
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:填空题
(8分)
(1)在水溶液中,YO3n—和S2-发生反应的离子方程式如下:
YO3n—+3S2-+6H+=Y-+3S↓+3H2O,已知Y为1~18号 元素。
元素。
(a)YO3n—中Y的化合价是__________; Y元素原子的最外层电子数是____________;
(b)S2-的半径__________Y-的半径(填“大于”或“小于”)。
(2)在一定条件下A与B反应可生成C和D,其能量变化如下图
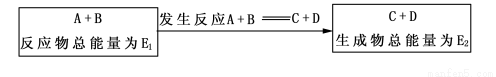
(a)若E1>E2,反应体系的总能量____(填“升高”“降低”),为___(填“吸热”“放热”)反应。
(b)若E1<E2,反应体系的总能量___(填“升高”“降低”),为______(填“吸热”“放热”)反应。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为
A.57 B.47 C.61 D.293
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
N、Cu、H、O、S、Mg是常见的六种元素:
(1)Mg位于元素周期表第___周期第____族;.N与O的基态原子核外未成对电子个数比为 ;Cu的基态原子电子排布式为___________
(2)用“>”或“<”填空:
碱性:Mg (OH)2 ____ Cu(OH)2 第一电离能:O____ N
离子化合物熔点:MgS____ MgO 稳定性:H2S____ H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种溶液呈酸性的盐,在25℃、101kPa下,已知该反应每消耗1mol H2SO4放热akJ,则该反应的热化学方程式为_________。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽)。写出该反应的化学方程式,并标出电子转移的方向和数目_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市西北狼教育联盟高三第二次联合考试理综化学试卷(解析版) 题型:选择题
下列各项比较中前者高于(或大于或强于)后者的是
A.CH4和SiH4的熔点
B.I2在H2O中的溶解能力和I2在CCl4中的溶解能力
C.H2SO3和H2SO4的酸性
D.对羟基苯甲醛(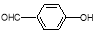 )和邻羟基苯甲醛(
)和邻羟基苯甲醛(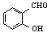 )的沸点
)的沸点
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市朝阳区高三4月第一次综合练习理综化学试卷(解析版) 题型:填空题
(13分)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
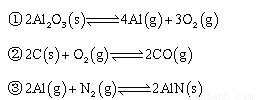
(1)断开N2分子内的共价键要 热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响 。
(3)Al2O3、C、N2合成AlN的平衡常数表达式K= 。
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):
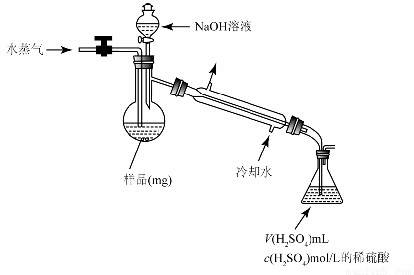
①AlN与NaOH溶液反应产生NH3的化学方程式是 。
②锥形瓶内吸收NH3的离子方程式是 。
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液, (将检验过程补充完整)。
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为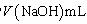 。下面有关计算正确的是 。
。下面有关计算正确的是 。
A.样品中AlN的质量: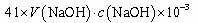
B.AlN的质量分数:
C.锥形瓶吸收NH3的物质的量: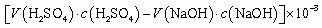
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com