
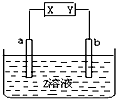
 用如图所示电解装置分别完成以下要求,请填空:
用如图所示电解装置分别完成以下要求,请填空:分析 (1)若a极质量减轻,则a为阳极与电源正极相连失电子发生氧化反应,所以b为阴极与电源负极相连得电子发生还原反应;
(2)若a、b均为石墨棒,Z溶液为稀硫酸,阳极上氢氧根失电子发生氧化反应;
(3)若X为负极,则a为阴极氢离子得电子发生还原反应同时生成氢氧根,b为阳极氯离子失电子发生氧化反应,据此分析;
(4)要在铁片上镀银,则铁为阴极,银为阳极,电解质溶液为硝酸银溶液;
(5)若用此装置制备金属钠,则为电解熔融的氯化钠;
(6)若用此装置保护b金属,则b金属作阴极;
(7)电解AgNO3溶液,阳极氢氧根失电子发生氧化反应生成氧气同时生成氢离子,阴极银离子失电子发生氧化反应生成银,根据得失电子守恒判断.
解答 解:(1)若a极质量减轻,则a为阳极与电源正极X相连,所以b为阴极与电源负极Y相连,故答案为:负;
(2)若a、b均为石墨棒,Z溶液为稀硫酸,阳极上氢氧根失电子发生氧化反应生成氧气和水,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(3)Z溶液为滴有酚酞的氯化钠溶液,若X为负极,则a为阴极氢离子得电子发出氢气同时剩余氢氧根,b为阳极氯离子失电子生成氯气,所以先变红的是a极,该电解池中总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:a;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)要在铁片上镀银,则铁为阴极,银为阳极,电解质溶液为硝酸银溶液,又已知Y为负极,所以与Y相连的b为阴极是铁,a为阳极是银,z为硝酸银溶液,故答案为:银;铁;硝酸银溶液;
(5)用此装置制备金属钠,则为电解熔融的氯化钠,所以Z溶液换为熔融的氯化钠;故答案为:熔融的氯化钠;
(6)若用此装置保护b金属,则b金属作阴极,a为阳极,所以X应为正极,故答案为:正;
(7)电解AgNO3溶液,阳极氢氧根失电子发生氧化反应生成氧气,阴极银离子失电子发生氧化反应生成银,电解总反应为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,所以阴极与阳极电极产物的物质的量比为4:1,电解一段时间后,溶液的pH降低,故答案为:4:1;降低.
点评 本题考查了电解原理及其应用等知识点,明确电极原理内涵及应用即可解答,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
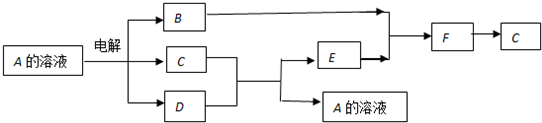
 ,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B 同周期第一电离能最小的主族元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: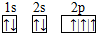 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲肾上腺素的分子式为:C8H10NO3 | |
| B. | 1 mol去甲肾上腺素最多能与2 mol Na发生反应 | |
| C. | 1 mol去甲肾上腺素最多能与2 mol Br2发生取代反应 | |
| D. | 去甲肾上腺素能发生加成、取代、消去和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 名称为:2,5-二甲基-2,4-己二烯
名称为:2,5-二甲基-2,4-己二烯 名称为:2,4-二甲基-3-乙基戊烷.
名称为:2,4-二甲基-3-乙基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
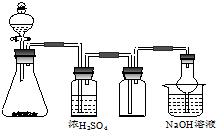 如图是一套实验室制备气体的装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )
如图是一套实验室制备气体的装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )| A. | 电石和水 | B. | 高锰酸钾和浓盐酸 | ||
| C. | Cu片和稀硝酸 | D. | FeS和稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com