
【题目】右图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述不正确的是( )
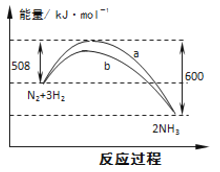
A.该反应的热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = -92kJ·mol-1
2NH3(g) ΔH = -92kJ·mol-1
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂, 该化学反应的活化能和反应热都改变
D.在温度体积一定的条件下, 通入lmol N2和3molH2 反应后放出的热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
【答案】C
【解析】
试题分析:A、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g)2NH3(g),△H=-92kJmol-1,故A正确;B、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故B正确;C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故C错误;D、向密闭容器中通入1mol N2和3mol H2,不可能完全转化,所以达到平衡时放出热量Q1kJ<92.4kJ;另一容积相同的密闭容器中通入2mol N2和6mol H2,达到平衡时放出热量理论上讲应该是2×92.2kJ=184KJ,但反应物不可能充分进行彻底,所以Q2<184KJ,同时通入2mol N2和6mol H2的压强比通入1mol N2和3mol H2的大了,平衡还会向正向移动,放出的热量还会增大,即Q2>2Q1,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】无机盐在生命活动中不可缺少,合成叶绿素和血红蛋白分子必需的离子分别是( )
A. Mg2+、Fe2+ B. Ca2+、Mg2+
C. PO43-、K+ D. K+、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图像的分析正确的是
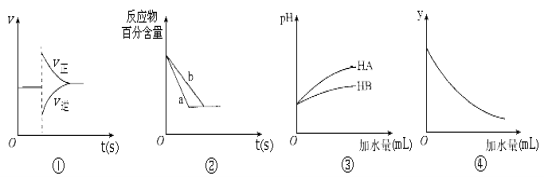
A.图①表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减少NH3浓度时速率的变化
2NH3(g)达到平衡后,减少NH3浓度时速率的变化
B.图②中a、b曲线分别表示反应H2(g)十I2(g)![]() 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③说明HB是比HA更弱的酸
D.图④中的y可表示将冰醋酸加水稀释时溶液导电能力的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液, 滴定时左手旋转 的玻璃活塞,右手不停地摇动 ,两眼注视 ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 4.20 | 25.70 |
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:

(1)由图中的数据分析,该反应的化学方程式为________________。
(2)反应开始至2min、5minZ的平均反应速率为_____________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究利用催化技术将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO (g)![]() 2CO2(g)+N2(g) △H.
2CO2(g)+N2(g) △H.
为了测定在某种催化剂作用下的反应速度,某温度下,在容积固体的容器内进行此反应,并用气体传感器测得不同时间的NO和CO浓度如表:
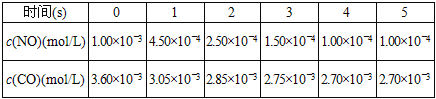
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在该反应的平衡常数的表达式K=________________。
(2)该反应在此温度下能够自发进行,说明△H___________0(填写“>”、“<”、“=”)。
若只将反应条件改为绝热,平衡时NO的浓度将___________(填“增大”、“减小”、“不变”)
(3)前2s内的平均反应速率v(N2)__________________.
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
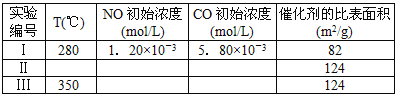
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,参考实验I实验条件下混合气体中NO浓度随时间变化的趋势曲线图,画出II、III条曲线图,并标明各条曲线的实验编号。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.lmolNaCl 固体中含有NA个Na+
B.18gD2O和18gH2 O中含有的质子数均为10NA
C.标准状况下2.24LH2O 含有的共价键数为0.2NA
D.密闭容器中2molNO 与lmolO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
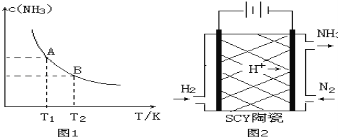
当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”)。
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
若N2(g)+3H2(g)=2NH3(g) △H=a kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com