
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述八种元素中,最高价氧化物水化物酸性最强的化合物的化学式是 ,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是 ,最高价氧化物水化物显两性的氢氧化物的化学式是 。
(2)③与④的气态氢化物的稳定性由大到小的顺序是 。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
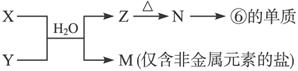
X溶液与Y溶液反应的离子方程式为______________________________________。
【知识点】元素周期表、元素周期律的应用
【答案解析】(共10分)(除(5)(6)是2分其余每空1分)
(1)HClO4 NaOH Al(OH)3 (2)H2O>NH3 (3)O2->Na+>Al3+
(4)HNO3>H2CO3>H2SiO3
(5) 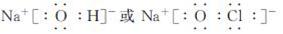
(6) Al3++3NH3·H2O===Al(OH)3↓+3NH4+
解析:根据①∽⑧八种元素在周期表中的位置,可以判断出这八种元素分别为:H、C、N、O、Na、Al、Si、Cl。
(1)最高价氧化物水化物的酸性与非金属的非金属性有关,非金属性越强,最高价氧化物水化物的酸性越强。在这八种元素中Cl元素的非金属性最强,故其形成的最高价氧化物水化物的酸性应最强。最高价氧化物水化物的碱性与金属的金属性有关,金属性越强,最高价氧化物水化物的碱性越强。在这八种元素中Na元素的金属性最强,故其形成的最高价氧化物水化物的碱性应最强。最高价氧化物水化物显两性的氢氧化物为Al(OH)3。
(2)气态氢化物的稳定性与非金属的非金属性有关,非金属性越强,气态氢化物的稳定性越强。O元素的非金属性强于氮元素的,故其气态氢化物的稳定性强。
(3)④、⑤、⑥形成的离子分别为O2-、Na+、Al3+,这三种离子的电子层结构相同,核内质子数不同,核内质子数越多,离子半径越小,故离子半径由大到小的顺序是O2->Na+>Al3+。
(4)最高价含氧酸的酸性与非金属的非金属性有关,非金属性越强,最高价含氧酸的酸性越强。②、③、⑦三种元素分别为C、N、Si,非金属性的强弱顺序为N>C>Si,故最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3。
(5)①、④、⑤、⑧元素形成的既含离子键又含极性共价键的化合物有:NaOH,NaClO, NaClO3等,根据中学阶段中最熟悉的物质可以写出其中的一些物质的电子式。
(6)根据图示信息M仅含非金属元素的盐,可知M为铵盐,则X和Y中有一种物质提供铵根离子。⑥为Al,故N为氧化铝,Z为氢氧化铝,这样可以得到X与Y的反应应是在可溶性的铝盐中通入氨气。
【思路点拨】本题以元素周期表为载体考查了元素周期律的应用,金属性、非金属性的强弱的比较,微粒半径大小的比较,电子式的书写,物质之间的相互转化等,试题的综合性较强。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
写出适当的计算过程
(1)右图是硫酸试剂瓶标签上的部分说明文字。
试计算:该硫酸溶液中H2SO4的物质的量浓度是多少?
(2)将上述浓硫酸加水稀释至2mol·L-1 ,取50 mL该稀硫酸溶液与足量的锌粉反应,则标准状况下生成氢气体积为多少L?
 (3)请认真阅读下面某矿泉水标签内容,计算:
(3)请认真阅读下面某矿泉水标签内容,计算:
该矿泉水中镁离子的物质的量浓度的最大值为多少?

查看答案和解析>>
科目:高中化学 来源: 题型:
乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式: 。
(2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。
(4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3 mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使酸性KMnO4溶液褪色 ②苯分子中碳原子间的距离均相等 ③苯能在一定条件下跟H2加成生成环已烷 ④经实验测得邻二甲苯仅一种结构 ⑤苯在FeBr3存在条件下与液溴发生取代反应,但不因化学变化而使溴水褪色
A.②③④⑤ B.①②③④ C.①②④⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.稀硫酸不具有氧化性 B.NH4Cl中只含有离子键
C.可用丁达尔效应区分溶液和胶体 D.金属阳离子被还原时一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A. NO2通入FeSO4溶液中 B. CO2通入CaCl2溶液中
C. NH3通入AlCl3溶液中 D. SO2通入已酸化的Ba( NO3 )2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
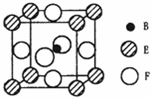 (5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是:
A.5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
B.14g乙烯、丙烯的混合气体含有C-H数为2NA
C.标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com