
| A. | +4价氧化物都能与氢氧化钠溶液反应 | |
| B. | 单质在加热时都能与氧气反应 | |
| C. | 氧化物都能溶于水生成相应的酸 | |
| D. | 碳和硅两种元素都有能导电的单质 |
科目:高中化学 来源: 题型:选择题
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | 36.1 | |
| 燃烧热(kJ•mol-1) | 1560.7 | 2877.6 | 3535.6 |
| A. | 丁烷的沸点有可能在0℃以下 | |
| B. | 上述四种烷烃中戊烷最容易液化,打火机中所用的燃料就是戊烷 | |
| C. | 丙烷完全燃烧生成4mol气态水,所放出的热量小于2877.6kJ | |
| D. | 烷烃的含碳量越高,其燃烧热值也就越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000 ml | B. | 500 ml | C. | 1500 ml | D. | 100 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率加快 | B. | 正反应速率减慢 | C. | 逆反应速率加快 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原硅酸是白色胶状物,失去部分水后变成白色粉末状硅酸 | |
| B. | SiO2分子由一个硅原子和两个氧原子构成 | |
| C. | SiO2溶于水后则慢慢生成硅酸 | |
| D. | SiO2既能与酸反应,又能与强碱反应,故它是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
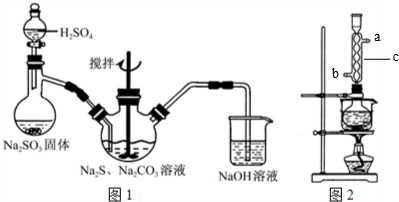
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中含有大量游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | Si、P、S、Cl相应的氧化物对应水化物的酸性依次增强 | |
| C. | 工业上通常用电解熔融氧化铝制得金属铝 | |
| D. | 金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
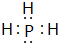 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com