
下列物质的量浓度关系错误的是( )
A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.等体积、等物质的量浓度的NaF溶液与HF溶液混合:c(Na+)=c(F-)+c(HF)
C.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c(Na+)>c(SO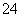 )>c(NH
)>c(NH )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
科目:高中化学 来源: 题型:
根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。如图表示298.15 K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
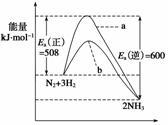
(1)若反应中生成2 mol氨,则反应________(填“吸热”或“放热”)________kJ。
(2)在图中曲线________(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是_____________________________________________________________
________________________________________________________________________。
(3)目前合成氨工业广泛采用的反应条件500℃、20 MPa~50 MPa、铁触媒,反应转化率不超过50%,工业上为了进一步提高氨气产率,你认为下列措施最经济可行的是
________________________________________________________________________。
A.降低反应温度,让反应向着有利于氨气生成的方向进行
B.升高温度,让更多的分子变成活化分子
C.寻求能在更低的温度下有很强催化活性的新型催化剂
D.寻求新型耐高压材料,将压强增大一倍
查看答案和解析>>
科目:高中化学 来源: 题型:
现有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1。下列说法正确的是(双选)( )
A.三种溶液的pH大小顺序是③>②>①
B.将三种溶液稀释相同倍数,pH变化最大的是③
C.分别加入25 mL 0.1 mol·L-1的盐酸后,溶液的pH大小顺序是①>③>②
D.三种溶液中,由水电离的c(OH-)大小顺序是③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,0.01 mol·L-1两种弱酸溶液的pH如表。下列说法正确的是( )
| 弱酸 | CH3COOH | HCN |
| pH | 3.4 | 5.6 |
A.相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,CH3COONa溶液的pH较大
C.等体积、相同pH的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH
D.HCN的电离平衡常数(Ka)与CN-的水解平衡常数(K)存在如下关系:Ka·K=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 NaHCO3溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO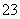 )>c(HCO
)>c(HCO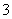 )>c(OH-)
)>c(OH-)
B.20 mL 0.1 mol·L-1 CH3COONa溶液与10 mL 0.1 mol·L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH )+c(OH-)
)+c(OH-)
D.0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
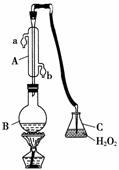
图1
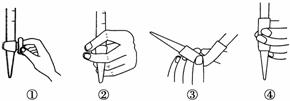
图2
(1)仪器A的名称是______,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)____________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
生活处处有化学。下列说法正确的是 ( )
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氢氟酸在水溶液中存在如下电离平衡:HFH++F-。只改变一个条件一定可以使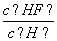 减小的是( )
减小的是( )
A.通入少量氯化氢气体 B.加入少量氟化钾固体
C.加入少量氢氧化钠固体 D.通入少量氟化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
A.打开盛装NO的集气瓶;冷却NO2气体
B.用冰水混合物冷却SO3气体;加热氯化铵晶体
C.木炭吸附NO2气体;将氯气通入品红溶液中
D.向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com