
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知()
A. 化学反应速率变化时,化学平衡一定发生移动
B. 化学平衡发生移动时,化学反应速率一定变化
C. 正反应进行的程度大,正反应速率一定大
D. 改变压强,化学反应速率一定改变,平衡一定移动
考点: 化学平衡的影响因素.
专题: 化学平衡专题.
分析: 化学平衡是否发生变化,取决于正逆反应速率的关系,如正逆反应速率相等,则平衡不移动,如正反应速率大于逆反应速率,平衡向正反应方向移动,否则向逆反应 方向移动,催化剂改变反应速率不改变化学平衡.
方向移动,催化剂改变反应速率不改变化学平衡.
解答: 解:A.正逆反应速率都变化但仍相等,则平衡不移动,故A错误;
B.化学平衡发生移动时,正逆反应速率不等,一定发生变化,故B正确;
C.反应向正反应方向进行时,说明正反应速率大于逆反应速率,但正反应速率不一定增大,也可能减小,此时逆反应速率更小,故C错误;
D.如反应前后气体的体积不变,增大压强,平衡也不移动,故D错误.
故选B.
点评: 本题考查化学平衡与反应速率的关系,题目难度不大,注意反应是否处于平衡状态,取决于正逆反应速率的大小关系.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
下列实验现象预测正确的是()
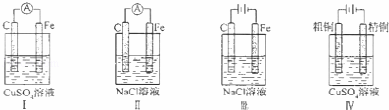
A. 实验Ⅰ:电流表A指针偏转,碳棒上有气泡冒出
B. 实验Ⅱ:电流表A指针偏转,铁极上有无色气体产生
C. 实验Ⅲ:碳棒上有无色气体产生,铁极上有黄绿色气体产生
D. 实验IV:粗铜溶解,精铜上有红色固体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是()
A. Cu能与浓硝酸反应,而不与浓盐酸反应
B. Cu与浓硝酸反应比与稀硝酸反应快
C. N2与O2在常温、常压下不反应,放电时可反应
D. Fe与浓盐酸反应快,与稀盐酸反应慢
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
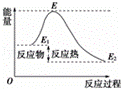
A. 反应物分子(或离子)间的每次碰撞是反应的先决条件
B. 反应物的分子的每次碰撞都能发生化学反应
C. 活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值
D. 活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E﹣E1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是()
A. HCl和NaOH反应的中和热△H=﹣5 7.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
7.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
B. 碳与二氧化碳的反应既是吸热反应,又是化合反应
C. 热化学方程式中化学计量数可表示分子个数
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是()
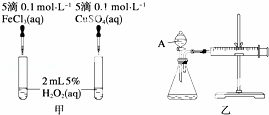
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol﹣1(用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中发生反应的离子方程式为:Zn+2H+═Zn2++H2↑,下列说法错误的是()

A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜﹣锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
工厂的工业废水,不可直接往江河湖海中排放,否则会造成严重公害。某河道两旁有甲、乙两厂,它们排出的工业废水各含有K+、Fe3+、Ba2+、Ag+、Cl-、SO42-、NO3-、OH-中的四种。又知甲厂污水pH>7。
(1)甲厂污水中含有的四种离子可能是:_______________________________。
(2)乙厂污水中含有的四种离子可能是:______________________________。
(3)对乙厂废水进行处理,方法之一,可往废水中加入一定量的________(选填
“活性碳”“硫酸亚铁”或“铁粉”),可以回收其中的金属__________(填
元素符号)。
(4)消除污染的另一种重要措施是将甲、乙两厂的废水按比例混合,可使废水
中的________(填离子符号)转化为沉淀,从而大大降低污染程度。过滤后所
得废水主要含________,可用于浇灌农田。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com