
 ④H2O⑤NH3.
④H2O⑤NH3.| A. | ⑤④③②① | B. | ④⑤②③① | C. | ②⑤④③① | D. | ①③②⑤④ |
分析 根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,然后判断分子或离子的空间构型,再判断键角;
解答 解:①C2H2 分子中每个碳原子杂化轨道数为2,所以采取sp杂化,为直线形,键角为180°;
②CCl4分子中每个碳原子杂化轨道数为4,所以采取sp3杂化,为正四面体,键角为109°28′;
③ 分子中每个碳原子杂化轨道数为3,所以采取sp2杂化,为平面三角形,键角为120°;
分子中每个碳原子杂化轨道数为3,所以采取sp2杂化,为平面三角形,键角为120°;
④H2O分子中每个氧原子杂化轨道数为4,所以采取sp3杂化,为V形,键角为105°;
⑤NH3分子中每个氮原子杂化轨道数为4,所以采取sp3杂化,三角锥形,键角为107°;
所以键角由大到小排列顺序是①③②⑤④;
故选D.
点评 本题考查了原子杂化类型的判断,根据“杂化轨道数=δ键数+孤对电子对数”来解答即可,原子杂化类型的判断是高考的热点,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
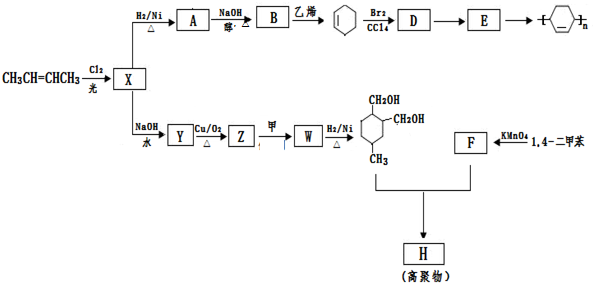
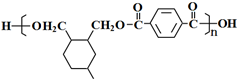
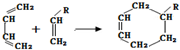 (或写成
(或写成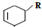 R代表取代基或氢)
R代表取代基或氢)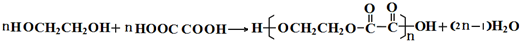
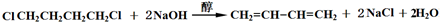 .
.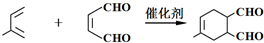 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
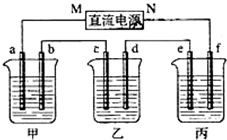 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
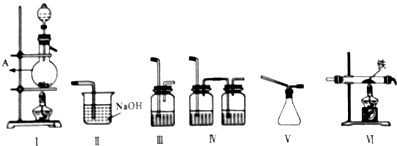
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
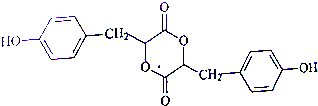
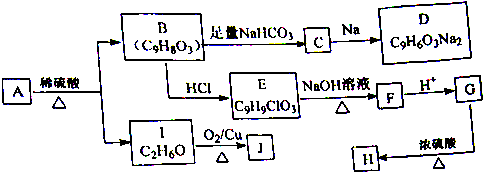
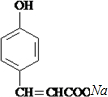
 .
. +
+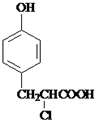 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力、范德华力、氢键 | B. | 范德华力、范德华力、共价键 | ||
| C. | 共价键、共价键、共价键 | D. | 范德华力、氢键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
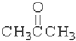 ③
③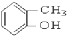 ④
④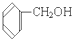 ⑤
⑤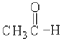 ⑥
⑥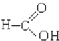
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
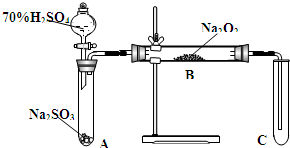 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com