
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
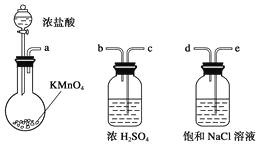
A.a b cdeefg–hB.aedcbhicbg
C.aed hicbgD.acb deh icbf
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
n(N2O5)/mol | 10.0 | 7.0 | 5.0 | 5.0 |
下列说法正确的是( )
A.在1000s内,反应吸收的热量为2.5Q kJ
B.在500s内,O2分解速率为3×10-3 mol·L-1·s-1
C.在1000s时,反应恰好达到平衡
D.在1500s时,N2O5的正反应速率等于NO2的逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某原电池的装置图。其电池的总反应是:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)。请回答以下问题:
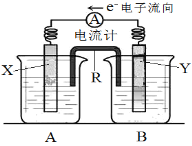
(1)R的名称是__________,R中的阳离子移向________(填“A”或“B”)中的溶液。
(2)电极Y的材料是______________,B中的电解质溶液是________________。
(3)X为原电池的______(填“正”或“负”)极,其电极反应式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热。
(1)已知在298K时下述反应的有关数据:C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据如图提供的信息,写出该反应的热化学方程式____________________________,下图的曲线中________(填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
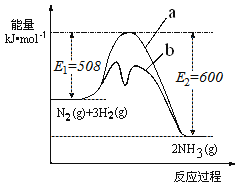
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是_____________。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n molN2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1 L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K=_______________。
(4)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 |
| 1 |
ⅱ | ______ |
| 10 |
ⅲ | 480 | ______ | 10 |
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为________________________。
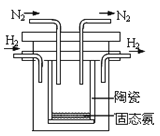
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中的四种主族元素A、B、C、D、E,原子序数依次增大。A是电负性最大的元素,B、D的价电子层中均有两个未成对电子,回答下列问题:
(1)B元素在周期表中的位置为___________________________;
(2)A的基态原子中,电子占据的最高能级符号为___;该能级的电子云轮廓图形状为__________;
(3)B、C、D三种元素的第一电离能大小顺序为________;该电离能大小变化的原因为________________;
(4)C、D、E三种元素的最高价氧化物的水化物的酸性强弱顺为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
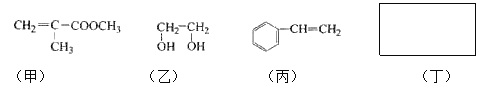
填写下列空白:
(1)甲中不含氧原子的官能团是____________;下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):

A的分子式是___________,试剂X可以是___________。
(4)已知: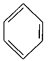 +RCl
+RCl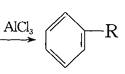 +HCl(-R为烃基)
+HCl(-R为烃基)
 +H2
+H2
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 ______________ 。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常涉及到一些重要的中学化学反应,以下有关叙述正确的是
A.工业上,用焦炭在高温下还原二氧化硅制得粗硅
B.通常将氯气通入到饱和石灰水中制得大量漂白粉
C.工业制硫酸将SO2氧化成SO3的条件一般选择高温、高压、催化剂
D.钠可把钛、锆、铌、钽等金属从它们的卤化物溶液里还原出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com