
【题目】下列说法中正确的是( )
A. 催化剂能增大活化分子的百分数,从而成倍地增大反应速率
B. 恒压容器中发生反应N2+O2![]() 2NO,若在容器中充入He,正逆反应的速率均不变
2NO,若在容器中充入He,正逆反应的速率均不变
C. 当一定量的锌粉和过量的6 mol·L-1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入一些水、CH3COONa溶液或NaNO3溶液
D. 已知t1 ℃时,反应C+CO2![]() 2CO ΔH>0的速率为v,若升高温度正反应速率减小
2CO ΔH>0的速率为v,若升高温度正反应速率减小
【答案】A
【解析】
A. 催化剂可以改变反应的路径,降低反应所需要的活化能,从而增大活化分子的百分数;
B. 恒压容器中充入不反应的气体,导致容器的体积增大,使得物质的浓度减小;
C. 加水会使物质浓度减小,CH3COONa溶液会结合酸中的氢离子,使酸浓度减小,而NO3-加入后会与溶液中的氢离子结合成硝酸,硝酸与锌反应生成氮的氧化物;
D. 温度升高,化学反应速率增大,与反应吸热或放热没有关系。
A. 催化剂可以改变反应的路径,降低反应所需要的活化能,从而增大活化分子的百分数,使有效碰撞几率提高,故A项正确;
B. 在恒压容器中充入不参加反应的气体,导致容器的体积增大,反应物和生成物的浓度均减小,正、逆反应速率都减小,故B项错误;
C.若使溶液中氢离子浓度减小,则反应速率将减慢,因此可选水或CH3COONa溶液,但不能用NaNO3溶液,在酸性溶液中NO3-将和锌粉发生氧化还原反应,生成氮的氧化物,从而使生成的H2的量减少,故C项错误;
D. 温度升高,正、逆反应的速率均增大,故D项错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定大量共存的是( )
A. 含有AlO2-的溶液中:Na+ 、Al3+、Cl-、K+
B. 常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH![]() 、Cl-
、Cl-
C. 常温下 c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
D. 在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯霉素(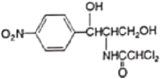 )曾用作广谱抗菌药物,一种合成路线如下:
)曾用作广谱抗菌药物,一种合成路线如下:
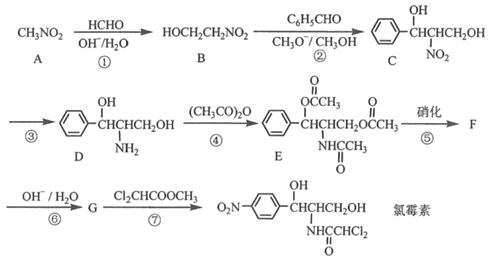
已知: 的性质与酯基相似。
的性质与酯基相似。
(1)A的化学名称为___________。
(2)D所含官能团的名称为___________;可以检测有机化合物中存在何种官能团的仪器是__________。
(3)反应②和③的反应类型分别是___________、_____________。
(4)设计反应④和⑥的目的是_________________________________________。
(5)由F到G的化学方程式为_________________________________________。
(6)芳香化合物X(C6H7NO2),与D具有相同的官能团,X的可能结构共有________种(不考虑立体异构):其中核磁共振氢谱为四组峰,峰面积比为2:2:2:1,其结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据周期表中元素原子结构性质回答下列问题:
(1)C原子价层电子的轨道表达式为___________,基态As原子中,核外电子占据的最高能级的电子云轮廓图为___________形。
(2)已知等电子体具有相似的结构和化学键特征,O22+与元素N的单质互为等电子体,则O22+的电子式为___________。
(3)NH3能与众多过渡元素离子形成配合物,向CuSO4溶液中加入过量氨水,得到深蓝色溶液,向其中加人乙醇析出深蓝色晶体,加入乙醇的作用___________,该晶体的化学式为___________。
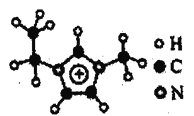
(4)如图EMIM+离子中,碳原子的杂化轨道类型为___________。分子中的大π键可用符号πnm表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则EMM+离子中的大π键应表示为___________。
(5)NiO晶体结构与NaCl相似,晶胞中Ni2+位置在顶点和面心,则晶胞中O2-位置在___________,已知晶体密度为dg/cm3,N2+原子半径为xpm,O2-原子半径为ypm阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为___________(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,反应①:I2(aq)+I-(aq)![]() I3-(aq) △H1;反应②: I3-(aq)
I3-(aq) △H1;反应②: I3-(aq) ![]() I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K1 | 1100 | 841 | 680 | 533 | 409 |
请回答:
(1)若反应②的化学平衡常数为K2,在相同温度下,K1·K2=____________。
(2)上述反应①的△H1_______0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会______(填“加快”、“减慢”或“不变”)。
(3)能判断反应①已达到平衡的依据是_______________
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800。在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(I2) | 0.1 | 0.2 | 0.2 |
c(I-) | 0.2 | 0.1 | 0.2 |
反应速率最快的是_____________(填“甲”、“乙”或“丙”),平衡时I2的转化率最大的是__________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
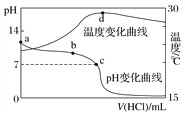
A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是(____)
A.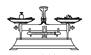 称量
称量
B.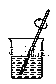 溶解
溶解
C.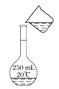 转移溶液
转移溶液
D.![]() 定容
定容
(2)下列几种导电性变化图像,把符合要求的图像序号填在相应的题目后面括号中。
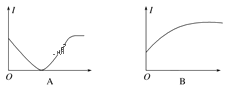
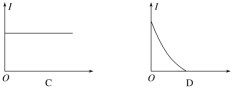
①向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液(____)
②向AgNO3溶液通入少量HCl(____)
③向氨水中通入HCl直至过量(____)
④向饱和石灰水中不断通入CO2(____)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
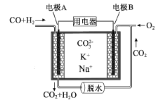
A.电极A上发生的是还原反应
B.电池工作时,![]() 向电极B移动
向电极B移动
C.电极B上发生的电极反应为:O2+2CO2+4e-=2![]()
D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铜(Cu)、砷(As)、镓(Ga)等形成的化合物在现代工业中有广泛的用途,回答下列问题:
(1)基态铜原子的价电子排布式为_____________,价电子中未成对电子占据原子轨道的形状是__________________________。
(2)化合物AsCl3分子的立体构型为________________,其中As的杂化轨道类型为_____________。
(3)第一电离能Ga__________As。(填“>”或“<”)
(4)若将络合离子[Cu(CN)4]2-中的2个CN- 换为两个Cl-,只有一种结构,则[Cu(CN-)4]2-中4个氮原子所处空间构型为_______________,一个CN-中有__________个π键。
(5)砷化镓是一种重要的半导体材料,晶胞结构如图所示。
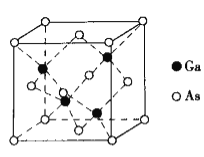
熔点为1238℃,密度为g·cm-3,该晶体类型为______________,Ga与As以__________键键合,Ga和As的相对原子质量分别为Ma和Mb,原子半径分别为racm和rbcm,阿伏加德罗常数值为NA,GaAs晶胞中原子体积占晶胞体积的百分率为____________________。(列出计算公式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com