
(1)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①上述两种解释中________(填“甲”或“乙”)正确。
②为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
③若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。(已知25 ℃时CH3COONH4溶液呈中性)
(2)有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙同学在制得的Mg(OH)2沉淀中加入浓CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:
甲同学的解释为:因为NH4Cl溶液中,NH +H2ONH3·H2O+H+,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
+H2ONH3·H2O+H+,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
乙同学的解释为:因为CH3COONH4===CH3COO-+NH ,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq),NH
,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq),NH +OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
+OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
你认为哪一位同学的解释是正确的?________,为什么?
__________________________________________________________________
_________________________________________________________________。
解析 (1)溶液中存在CH3COOHCH3COO-+H+电离平衡,加入CH3COONa,增大了CH3COO-浓度,平衡向左移动,c(H+)减小,pH增大。
(2)存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)。加入NH4Cl,NH 与OH-结合生成NH3·H2O,溶解平衡向右移动,Mg(OH)2沉淀溶解。
与OH-结合生成NH3·H2O,溶解平衡向右移动,Mg(OH)2沉淀溶解。
答案 (1)①乙 ②B ③乙(或甲) 增大(或不变)
(2)乙同学的解释是正确的 甲同学认为由NH 的水解所提供的H+中和了由Mg(OH)2电离出来的OH-,而忽视了NH4Cl电离的NH
的水解所提供的H+中和了由Mg(OH)2电离出来的OH-,而忽视了NH4Cl电离的NH 也能结合OH-,且电离的NH
也能结合OH-,且电离的NH 浓度又远远大于NH
浓度又远远大于NH 水解出的H+浓度。由于CH3COONH4溶液呈中性,因此不可能是溶液的水解产生的H+引起的Mg(OH)2沉淀溶解
水解出的H+浓度。由于CH3COONH4溶液呈中性,因此不可能是溶液的水解产生的H+引起的Mg(OH)2沉淀溶解


科目:高中化学 来源: 题型:
关于钠和钾元素的比较中,不正确的是( )
A.钾原子失电子比钠原子容易 B.钾离子氧化性比钠离子强
C.钾与水反应比钠剧烈 D.KOH碱性比NaOH强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关盐类水解的叙述中正确的是 ( )。
A.溶液呈中性的盐一定是强酸强碱盐
B.含有弱酸根盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是
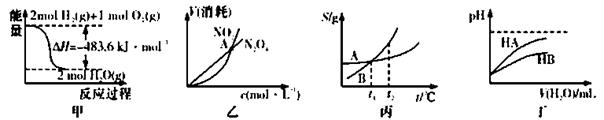
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=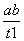 mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量Y,平衡后X体积分数与原平衡相比增大
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)铝元素在周期表中的位置为________。
(2)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金 相当。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。
现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高 温下煅烧,所得物质可作耐高温材料,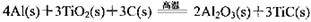
 则反应过程中,每转移1 mol电子放出的热量为________。
则反应过程中,每转移1 mol电子放出的热量为________。
(4)硅与铝同周期,地壳里硅铝的含量:硅________铝(填>,<或=)。是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成 。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
(5)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
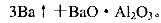 利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
_____________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示的是难溶氢氧化物在不同pH下的溶解度(S,mol/L),下列说法中正确的是( )
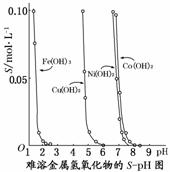
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com