
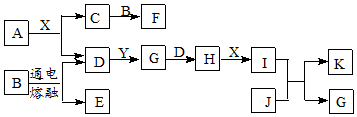
分析 A是一种淡黄色粉末,B是某种矿物中的主要成分,D、Y是空气含量最多的两种气体,X是最常见的无色液体,结合图中转化可知,X为H2O,A为Na2O2,则D为O2,C为NaOH,B为Al2O3,E为Al,F为NaAlO2,再结合J是一种紫红色金属,可知J为Cu,Y为N2,G为NO,H为NO2,I为HNO3,K为Cu( NO3)2,以此来解答.
解答 解:(1)A的化学式为Na2O2,故答案为:Na2O2;(2)Y的电子式为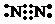
(3)I与J反应的化学方程式为3Cu+8HNO3 (稀)=3Cu( NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3 (稀)=3Cu( NO3)2+2NO↑+4H2O; (4)C与B在溶剂X中反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、相互转化为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中可能含有K+ | |
| B. | 该溶液中肯定含有NH4+、SO42-、AlO2-、NO3- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含K+,且c(K+)≥0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
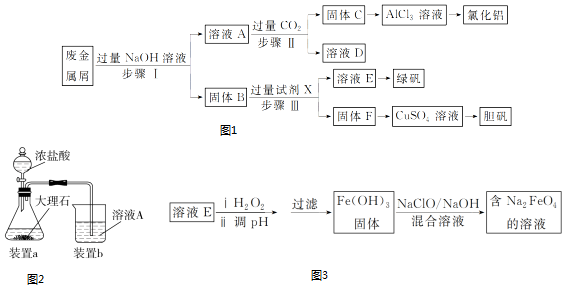
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2 和盐酸; Cu(OH)2 和 CH3COOH | |
| B. | BaCl2 和 Na2SO4; Ba(OH)2 和 CuSO4 | |
| C. | NaHCO3 和 NaHSO4; Na2CO3 和 NaHSO4 | |
| D. | NaHCO3(过量) 和 Ca(OH)2; Ca(HCO3)2 和 NaOH(过量) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
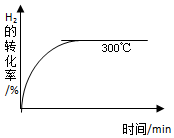 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaB溶液中水电离的OH-浓度大于10-7 mol/L | |
| B. | NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-) | |
| C. | NaB溶液中:c(Na+)+c(H+)=c(HB)+c(B-) | |
| D. | HB的电离方程式为:HB═H++B- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com